
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
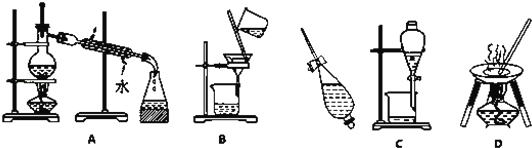
请根据混合物分离或提纯的原理,将A、B、C、D 填入适当的空格中.
(1)用四氯化碳碘水中提取碘_____;
(2)除去粗盐中的泥沙_____;
(3)与海水晒盐原理相似的是_____;
(4)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____.
【答案】C B D A
【解析】
蒸馏是依据混合物中各组分沸点不同而分离的一种法;过滤是适用于不溶性固体和液体之间的一种分离方法。萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法。蒸发法适用于从溶液中获得溶解度受温度影响小的溶质的一种方法。根据装置图可知A、B、C、D操作分别为蒸馏、过滤、萃取分液、蒸发。
(1) 单质碘易溶在有机溶剂中,用四氯化碳萃取分液即可提取碘水中的碘,选用C装置;
(2) 泥沙不溶于水,除去粗盐中的泥沙用过滤的方法,选B装置;
(3) 海水晒盐采用的是蒸发溶剂的方法,与海水晒盐原理相似的是D装置;
(4) CCl4、甲苯是沸点不同的两种液体,分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物用蒸馏法,选A装置。


科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________。
(3)步骤Ⅲ中,加入锌粉的作用是______________。
(4)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如下图所示。实验室中应置于____________(填仪器名称)焙烧样品。分析数据,100℃时发生反应的化学方程式为 ______________________________;680℃时所得固体的化学式为__________(填字母符号)。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( )

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,该反应的离子方程式为:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是( )
A.H2SO4在电流作用下在水中电离出H+ 和SO42
B.NaCl溶液能导电是因为溶液中有自由移动的Na+ 和Cl
C.由单质X变为X2-的反应是氧化反应
D.某元素处于最高价态时只具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
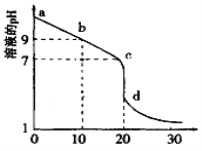
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 _____________________________ 。
(2)在A至F中任选元素,写出一种含非极性键的离子化合物的电子式 _________ 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的电子式是 _________ ,该物质与E的同周期相邻主族元素的单质反应的化学方程式为__________________ 。
(4)F单质与E的最高价氧化物的水化物反应的化学方程式为_________________________。
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com