
【题目】如图所示图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格中,并写出所发生反应的离子方程式.

(1)表示向饱和AlCl3溶液中滴加氨水至过量的是 ______ ,离子方程式:_____ 。
(2)表示向饱和AlCl3溶液中滴加NaOH至过量的是 ______,NaOH过量时的离子方程式:_____。
(3)表示向饱和石灰水中通入CO2至过量的是 _____,CO2少量时的化学方程式:_____。
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的是 ______,Mg2+生成沉淀的离子方程式: ______ 。
【答案】C Al3++3NH3H2O=Al(OH)3↓+3NH4+ B Al(OH)3+OH═AlO2+2H2O A Ca2++2OH+CO2=CaCO3↓+H2O D Mg2++2OH═Mg(OH)2↓
【解析】
(1)饱和AlCl3溶液中滴入稀氨水生成沉淀氢氧化铝,氢氧化铝不溶于弱碱氨水;
(2)饱和AlCl3溶液中滴加NaOH溶液,生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠溶液反应而溶解;
(3)氢氧化钙通入二氧化碳,先反应生成碳酸钙沉淀,然后碳酸钙与二氧化碳和水反应生成碳酸氢钙而溶解;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,生成两种沉淀:氢氧化镁和氢氧化铝,随着反应的进行沉淀量增大,但氢氧化铝溶于强碱,氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,沉淀会部分溶解。
(1)向饱和AlCl3溶液中滴加氨水至过量,发生反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,一水合氨属于弱碱,氢氧化铝不溶于弱碱,所以沉淀的质量不变,图象C符合该过程;
故答案为:C; Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(2)饱和AlCl3溶液中滴加NaOH溶液,首先发生反应:Al3++3OH═Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+OH═AlO2+2H2O,沉淀溶解,根据方程式可知:1molAlCl3反应,生成沉淀和沉淀溶解,消耗的NaOH的物质的量分别为3mol和1mol,图象B符合该过程;
故答案为:B; Al(OH)3+OH═AlO2+2H2O;
(3)饱和石灰水通过量CO2气体,首先发生反应生成碳酸钙:Ca2++2OH+CO2=CaCO3↓+H2O,然后碳酸钙与二氧化碳反应,沉淀溶CaCO3+CO2+H2O=Ca2++2HCO3,生成沉淀和沉淀溶解所用CO2相等,图象A符合该过程;
故答案为:A;Ca2++2OH+CO2=CaCO3↓+H2O;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,发生反应:Al3++3OH═Al(OH)3↓、Mg2++2OH═Mg(OH)2↓生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,但氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,然后发生Al(OH)3+OH═AlO2+2H2O,随着氢氧化钠溶液的加入,沉淀量减少,但不会完全溶解,图象D符合该过程;
故答案为:D; Mg2++2OH═Mg(OH)2↓。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3<Na2CO3
B.在水中的溶解性:NaHCO3<Na2CO3
C.与盐酸反应的速率:NaHCO3<Na2CO3
D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
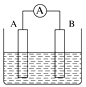
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是__(填字母)。
A 铝片、铜片 B 铜片、铝片
C 铝片、铝片 D 铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:____。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:___;该电池在工作时,A电极的质量将_(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为__。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出B电极反应式:_________;该电池在工作一段时间后,溶液的碱性将___(填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:________;若该电池反应消耗了6.4克CH4,则转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应:
a.![]()
b.![]()
请回答下列问题:
(1)上述两个化学反应中有一个不可用于设计原电池,它是__________(填写代号),其原因是__________;另一个可用于设计原电池,该原电池中,负极反应式是____________,正极反应式是___________,电池总反应的离子方程式是_______________。
(2)如果利用化学反应Cu+2Fe3+=Cu2++2Fe2+,设计原电池,请在如图方框中标明电极材料和电解质溶液的名称(图中“I”表示电流)。______、______、______
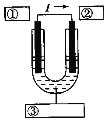
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼钛的有关反应如下所示:
① C(s) + O2(g) ![]() CO2(g) ΔH1
CO2(g) ΔH1
② 2CO(g) + O2(g) ![]() 2CO2(g) ΔH2
2CO2(g) ΔH2
③ TiO2(s) + 2Cl2(g) ![]() TiCl4(g) + O2(g) ΔH3
TiCl4(g) + O2(g) ΔH3
④ TiCl4(s) + 2Mg(s) ![]() 2MgCl2(s) + Ti(s) ΔH4
2MgCl2(s) + Ti(s) ΔH4
⑤ TiO2(s) + 2Cl2(g) + 2C(s) ![]() TiCl4(g) + 2CO(g) ΔH5
TiCl4(g) + 2CO(g) ΔH5
下列有关推断正确的是( )
A. 2ΔH1=ΔH2 B. ΔH1<0,ΔH2>0
C. ΔH5=ΔH3+2ΔH1-ΔH2 D. 2ΔH1-ΔH2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是______,键长较长的是_____。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)醋酸的球棍模型如图1所示。
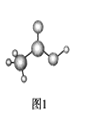
①在醋酸中,碳原子的轨道杂化类型有________;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
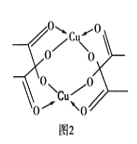
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1000mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
填空完成问题:
(1)该滴定实验所需的玻璃仪器有___。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.漏斗
(2)不用___(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因__。
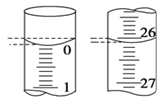
(3)滴定终点的现象为__。
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为__mL,终点读数为__mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol/LKMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为__。
(6)下列操作中可能使测定结果偏低的是__(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E各物质的关系如下图所示:

已知:X能使湿润的红色石蕊试纸变蓝。
(1)无色液体A是_____,A与B反应的化学方程式是____________。
(2)由X转化为N2的化学方程式为______________。
(3)白色固体C的化学式为 _____。由D转化为E的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com