
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
【答案】B
【解析】
A、根据图象0.1mol/LHX溶液中lg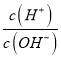 =12,
=12,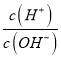 =1×1012,c(H+)c(OH-)=1×10-14,解得c(H+)=0.1mol/L,HX为强酸,0.1mol/LHY溶液中lg
=1×1012,c(H+)c(OH-)=1×10-14,解得c(H+)=0.1mol/L,HX为强酸,0.1mol/LHY溶液中lg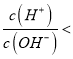 12,HY为弱酸,选项A正确;
12,HY为弱酸,选项A正确;
B、b点时溶液中lg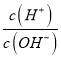 =0,溶液中c(H+ )=c(OH-) ,溶液呈中性;d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,HX电离出H+使d点溶液呈酸性,c点得到等物质的量浓度的NaY和HY的混合液,c点溶液呈酸性,HY的电离程度大于Y的水解程度,d点溶液中c(H+ )大于c点,d点溶液中H+对水的电离的抑制程度大于c点,水的电离程度: b> c>d,选项B正确;
=0,溶液中c(H+ )=c(OH-) ,溶液呈中性;d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,HX电离出H+使d点溶液呈酸性,c点得到等物质的量浓度的NaY和HY的混合液,c点溶液呈酸性,HY的电离程度大于Y的水解程度,d点溶液中c(H+ )大于c点,d点溶液中H+对水的电离的抑制程度大于c点,水的电离程度: b> c>d,选项B正确;
C、c点时加入n(NaOH)=0.005mol,此时得到等物质的量浓度的HY和NaY的混合溶液,lg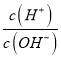 =6,则c(H+)=10-4mol/L,溶液呈酸性,说明HY的电离程度大于NaY的水解程度,故c(HY)<c(Y-),选项C错误;
=6,则c(H+)=10-4mol/L,溶液呈酸性,说明HY的电离程度大于NaY的水解程度,故c(HY)<c(Y-),选项C错误;
D、d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,c点得到等物质的量浓度的NaY和HY的混合液,溶液呈酸性,电离均大于水解, c(X-)>c(Y-)> c(Na+),选项D错误。
答案选B。


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
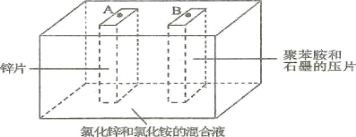
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
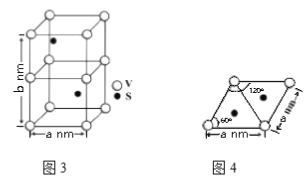
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
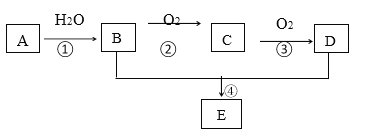
(1)D 分子中的官能团名称是_____。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A. 1.2mol·L-1·min-1B. 0.02mol·L-1·min-1
C. 1.8mol·L-1·min-1D. 0.18mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时气体A与气体B在某容器中反应生成气体C,反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图②所示。则下列结论正确的是( )

A.该反应的化学方程式是A+3B![]() 2C
2C
B.该反应的逆反应为吸热反应
C.压强增大,则该反应的正反应速率增大,逆反应速率减小
D.保持压强不变,向容器中充入少量氦气,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
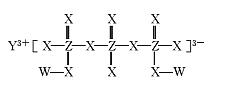
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com