
【题目】计算填空
(1)ARn+共有x个电子,则该阳离子的中子数________。
(2)AXn-共有x个电子,则该阴离子的中子数________。
(3)已知R原子有b个中子,R2+核外有a个电子,则R原子的组成符号是________。
(4)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为____________。
(5)已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则Wg R原子完全转化为R2-。其中含有的电子数为________(用NA表示阿伏伽德罗常数)。
【答案】A-x-n A-x+n a+b+2 a+2R ![]() (m-x+2) mol
(m-x+2) mol ![]() (m-x+2)NA
(m-x+2)NA
【解析】
根据阳离子的质子数=核外电子数+电荷数,阴离子的质子数=核外电子数-电荷数;以及各粒子之间关系进行计算。
(1)ARn+中的质子数=核外电子数+电荷数=x+n,中子数=质量数-质子数=A-(x+n);
(2)AXn-中的质子数=核外电子数-电荷数=x-n,中子数=质量数-质子数=A-(x-n);
(3)阳离子R2+中的质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,表示元素R原子组成符号为a+b+2 a+2R;
(4)ng A2-中所含电子的物质的量=![]() (m-x+2)=
(m-x+2)=![]() (m-x+2) mol;
(m-x+2) mol;
(5)元素原子的质量数为m,W克这种元素的原子,其物质的量为![]() mol,阴离子A2-核外有x个中子,则质子数为m-x,原子核内电子数为m-x+2,则W克这种阴离子的原子核内电子数为
mol,阴离子A2-核外有x个中子,则质子数为m-x,原子核内电子数为m-x+2,则W克这种阴离子的原子核内电子数为![]() (m-x+2)NA。
(m-x+2)NA。


科目:高中化学 来源: 题型:
【题目】下列关于钢铁冶炼的说法错误的是( )
①焦炭在炼铁中的作用是产生还原剂和热量
②炼钢中用纯氧代替空气做氧化剂,是为了防止产生污染
③炼铁高炉有两个进口、三个出口
④用含硫较多的生铁炼钢,应加入较多的生石灰
⑤炼铁、炼钢过程中都发生CaO+SiO2![]() CaSiO3
CaSiO3
⑥尽管铁的熔点是1 535 ℃,但高炉中的铁在1 200 ℃左右就呈液态
⑦生铁炼钢的主要目的调节硅锰等的含量、除去硫磷
A. ①⑥ B. ②⑦ C. ③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“瑞德西韦(Remdesivir)”对新型冠状病毒(SARS-CoV-2)有明显的抑制作用,其合成路线如下:
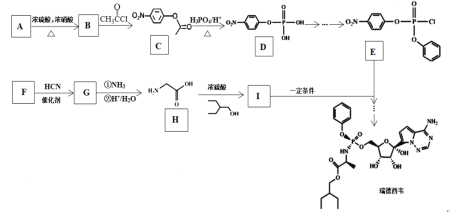
已知:![]()
(1)有机物G中官能团名称是________、_________。
(2)有机物H的化学名称为____________。
(3)A到B的反应类型是___________。
(4)有机物F的结构简式是__________。
(5)写出由B到C的反应方程式_________________。
(6)有机物M是C的一种同分异构体,满足下列条件的同分异构体有___种;其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为____________。
①苯环上有3个取代基 ②能发生银镜反应
③不能与FeCl3发生显色反应 ④能发生水解反应,且1 mol M消耗4 mol NaOH
(7)设计由苯甲醇为原料制备化合物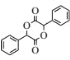 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①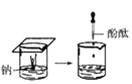 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②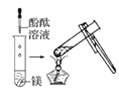 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③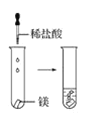 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④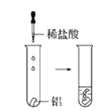 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O![]() +4Cl2+5H2O=2SO
+4Cl2+5H2O=2SO![]() +8Cl-+10H+
+8Cl-+10H+
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

(1)该图中有两处未画出,它们是______、__________。
(2)为什么所用NaOH溶液要稍过量_________________。
(3)倒入NaOH溶液的正确操作是_______________________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=______(结果保留一位小数)。
(6)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是 ( )

A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C. 在0≤pH≤5时,HMnO4溶液满足,pH= ![]()
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com