
| A、加水溶解,观察溶液温度变化 |
| B、取相同质量敞口放置,过一段时间在称量,比较质量变化 |
| C、取相同量,加入到氯化钡溶液中,观察是否有沉淀产生 |
| D、取相同量于试管中,加入铜片,加热观察,是否有刺激性气味的气体产生 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
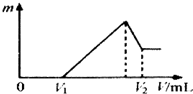 将镁、铝的混合物共0.2mol,溶于200mL 4mol?L-1的盐酸溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:
将镁、铝的混合物共0.2mol,溶于200mL 4mol?L-1的盐酸溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
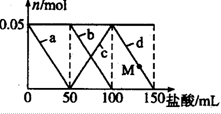 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br- |
| B、Cl- |
| C、OH- |
| D、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 将海带灼烧成灰 |
B、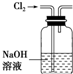 除去Cl2中混有的HCl气体 |
C、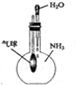 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com