
【题目】【2016年浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
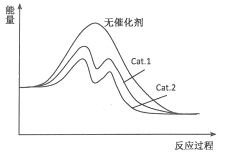
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
【答案】(1)![]() +41.2
+41.2
(2)CD
(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)
(5)阴 CO2+6H++6e==CH3OH+H2O
【解析】
试题分析:(1)根据平衡常数的公式,生成物的浓度幂之积与反应物浓度的幂之积的比值,书写平衡常数为![]() 。已知热化学方程式:a:CO(g)+
。已知热化学方程式:a:CO(g)+![]() O2(g)=CO2(g)△H= -283.0kJ·mol-1 b:H2(g)+
O2(g)=CO2(g)△H= -283.0kJ·mol-1 b:H2(g)+![]() O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)
O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)
H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,相同的反应时间内,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,相同的反应时间内,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ的催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为:

(5)二氧化碳变甲醇,碳元素的化合价降低,得到电子,说明其在阴极反应,其电极反应为: CO2+6H++6e-==CH3OH+H2O


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3 的混合液,经测定ClO-与ClO![]() 的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A. 21∶5 B. 11∶3 C. 3∶1 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
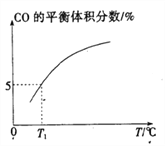
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了周期表中前20号元素中的十种元素的相关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | — |
最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是________(填元素编号),其最高价氧化物的水化物的电子式为___________;与H2最容易化合的非金属单质是________(写物质名称)。
(2)写出元素③形成的一种具有强氧化性的氢化物的结构式______________。
(3)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式______________;⑤的最高价氧化物的电子式为__________。
(4)短周期另一元素Q的原子半径为1.02×10-10m,则该元素在周期表中位于________________。
(5)写出④的最高价氧化物的水化物与⑦的最高价氧化物的水化物反应的离子方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2g块状大理石与30mL3mol/L盐酸反应制取CO2气体.若要增大反应速率,可采取的措施是
①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸
③改用2g粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键、共价键的叙述中正确的是( )
A.非极性键只存在于双原子的单质分子(如Cl2)中
B.在共价化合物里,可能存在离子键
C.在离子化合物里,只存在离子键,没有共价键
D.化学反应的实质是旧键的断裂,新键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014全国大纲卷】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
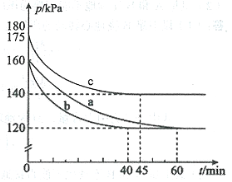
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿茶中含有的EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的一种衍生物A如图所示。有关衍生物A说法不正确的是( )

A.A在空气中易氧化,遇FeCl3溶液能发生显色反应
B.A能与碳酸氢钠溶液反应放出二氧化碳
C.1 mol A最多可与含9 mol氢氧化钠的溶液完全作用
D.1 mol A与足量的浓溴水反应最多可与6 mol Br2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质
B. Na2S具有还原性,因此可作为工业废水汞离子沉淀剂
C. 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com