
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
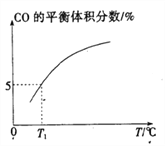
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
【答案】 4SO2+3CH4 ![]() 4H2S+3CO2+2H2O H2S
4H2S+3CO2+2H2O H2S![]() H ++HS- 8.0×10-3mol·L-1 1076 增大 反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大。 20% 0.044
H ++HS- 8.0×10-3mol·L-1 1076 增大 反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大。 20% 0.044
【解析】I.(1) 天然气与SO2反应,可制备H2S,同时生成两种能参与大气循环的氧化物应为H2O和CO2,则该反应的化学方程式为4SO2+3CH4 ![]() 4H2S+3CO2+2H2O;
4H2S+3CO2+2H2O;
II.(2) H2S是二元弱酸,在溶液中分步电离,第一步电离方程式为H2S![]() H ++HS- ;
H ++HS- ;
(3) 当Sn2+开始沉淀时,根据Ksp(SnS)=c(Sn2+)×c(S2-)=1.0×10-25,可知此时溶液中c(S2-)=1.0×10-25÷0.1=1.0×10-24mol·L-1,则溶液中c(Cd2+)=Ksp(CdS)÷c(S2-)=8.0×10-27÷1.0×10-24mol·L-1=8.0×10-3mol·L-1 ;
Ⅲ.(4)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1,则△H=(xkJ·mol-1+930kJ·mol-1)-(1606 kJ·mol-1+442 kJ·mol-1)=-42 kJ·mol-1,解得x=1076 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1,则△H=(xkJ·mol-1+930kJ·mol-1)-(1606 kJ·mol-1+442 kJ·mol-1)=-42 kJ·mol-1,解得x=1076 kJ·mol-1;
(5)①由图示可知随着温度升高,CO的平衡体积分数增大,原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大。;
②平衡时COS的转化率为![]() ×100%=20%;
×100%=20%;
COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始物质的量(mol) 1 1 0 0
变化物质的量(mol ) 0.2 0.2 0.2 0.2
平衡物质的量(mol) 0.8 0.8 0.2 0.2
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量(mol) 0.2 1 0 0.8
变化物质的量(mol ) x x x x
平衡物质的量(mol) 0.2-x 1-x x 0.8+x
此时CO的体积分数为5%,即0.2-x=3×5%,解得x=0.05,则平衡时COS的物质的量为0.8mol,H2的物质的量为0.85mol,CO的物质的量为0.15mol,H2S的物质的量为0.2mol,则T1℃时,反应i的平衡常数为![]() =
=![]() =0.044。
=0.044。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【百强校·2016届山西大学附中12月月考】已知热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) △H1= +218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 ( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A. 0.5 molAl与足量盐酸反应转移电子数为1NA
B. 标准状况下,11.2L SO3所含的分子数为0.5NA
C. 0.1molCH4所含的电子数为1NA
D. 46gNO2和N2O4的混合物含有的分子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯消毒剂是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,实验室中KClO3和浓盐酸在一定温度下反应会生成二氧化氯,其变化可表述为:
2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________。
(2)氧化剂与还原剂的物质的量之比是________________。
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm—3,为使用方便,请计算出该浓盐酸中HCI的物质的量浓度________________mol·L—l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃经催化加氢后,不能得到2-甲基丁烷,该烃是
A. 2-甲基-1-丁烯 B. 2-甲基-2-丁烯 C. 3-甲基-1-丁炔 D. 3,3-二甲基-1-丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于现行的元素周期表的说法正确的是( )
A.短周期是指第一、二周期
B.IA族的元素全部是金属元素
C.元素周期表有8个副族
D.元素周期表有18个纵行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com