
����Ŀ��[���ʽṹ������һѡ��3]
������̼��Ԫ�صĵ��ʼ��仯���������Ҫ���о���ֵ��
(1)��(Ge)�ĺ���ʮ��ϡ�٣��������㷺Ӧ���ڵ��ӡ���ѧ������������ҽѧ����Դ���������¿Ƽ�����
���ִ���ѧ�У�������__________�ϵ���������������Ԫ�ء���̬��ԭ���У������ܼ���ߵ�ԭ�ӹ���ϣ����еĵ�����Ϊ___________��
��ͨ��״����GeCl4����ɫҺ�壬�ӷ������۵�Ϊ-51.50C���е�Ϊ86.55�������������ѡ��ɴ˿���֪GeCl4Ӧ���ڹ��ۻ������������_______��Ҳ���Ⱥ�����Ԫ�صĵ縺�����Ӧ��_______1.7(����С��������������)��
(2)�ڹ������У�![]() ��ͼa��ʾΪ������ṹ��������ͨ�����ö���0ԭ�ӣ��γ���״��״����״����״�ṹ�IJ�ͬ�����Ρ�ͼb��ʾ��n�����������ӳɵĹ����������Si���ӻ���ʽΪ_____��Si��O��ԭ�Ӹ�����Ϊ________����ѧʽ�ɱ�ʾΪ__________��
��ͼa��ʾΪ������ṹ��������ͨ�����ö���0ԭ�ӣ��γ���״��״����״����״�ṹ�IJ�ͬ�����Ρ�ͼb��ʾ��n�����������ӳɵĹ����������Si���ӻ���ʽΪ_____��Si��O��ԭ�Ӹ�����Ϊ________����ѧʽ�ɱ�ʾΪ__________��

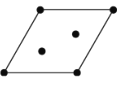
(3)ʯī�����ɲ�״ʯī����������ABAB��ʽ�ѻ����ɣ���ͼ(a)��ʾ��ͼ(b)��һ��ʯī����������ʾ��ͼ��

������ͼ �л���������c���ͶӰ (�����������̼ԭ��λ�ü���)_________��
�л���������c���ͶӰ (�����������̼ԭ��λ�ü���)_________��
������ʯī������Ϊh cm��C-C����Ϊr cm����ʯī�����ܶȵı���ʽΪ__________g.cm-3(�����ӵ�����ΪNA)��
���𰸡�ԭ�ӹ��� 2 ���۷е�ϵͣ��������л��ܼ� С�� sp3 1:3 ![]() ����
����![]() ��
�� 
![]()
��������
��1�����ִ���ѧ�У�������ԭ�ӹ����ϵ���������������Ԫ�أ�
Ge��32��Ԫ�أ�Ge����Χ�����Ų�ʽΪ4s24p2���ʺ����ܼ���ߵ�ԭ�ӹ���ϣ����еĵ�����Ϊ2��
��GeCl4�۷е�ϵͣ��������л��ܼ�������GeCl4Ӧ���ڹ��ۻ����
������Ϣ���縺�Բ�ֵ��С��1.7�����γɹ��ۼ������Ⱥ�����Ԫ�صĵ縺�����Ӧ��С��1.7��
��2����������ÿ��Siԭ�Ӽ۲���ӶԸ�������4������Siԭ�Ӳ���sp3�ӻ���
����ͼ��b����һ���ṹ��Ԫ�к���1���衢3����ԭ�ӣ���ѧʽΪ![]() ����
����![]() ����
����
��3���پ�����b����C���ͶӰ������������Cԭ�����ص���Ӱ��ͶӰΪ ��
��
��һ�����������Ϊ��������ߣ�ע�����������ʱ������C-C��������ָ������b���в�C��sp2�ӻ�������Cԭ�ӳɼ��ļ�������Ҫ�������ι�ϵ�������������C��C֮��ij��ȣ���C-C������Ϊb�������Ҷ����ɵ�
cos120��=![]() =
=![]() ����õ���C��C֮��ij���Ϊa=
����õ���C��C֮��ij���Ϊa=![]() ,��һ�����������ΪS=a2sin120��=
,��һ�����������ΪS=a2sin120��=![]() �����һ�����������ΪV0=Sh=
�����һ�����������ΪV0=Sh=![]() ��h��2=
��h��2=![]() pm3��1mol��������4molCԭ�ӣ���1mol����������Ϊm0=48g��1mol��������NA����������ʯī������ܶ�Ϊ��=
pm3��1mol��������4molCԭ�ӣ���1mol����������Ϊm0=48g��1mol��������NA����������ʯī������ܶ�Ϊ��=![]() =
=![]() g.cm-3��
g.cm-3��


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɢϵ�������ͺ�ˮ�γɵ�����Һ���ں�����ɳ��ʳ��ˮ�������е�(I2)�ľƾ���Һ�����Ҷ����ͱ������Ļ����Һ(�Ҷ����ͱ������IJ����������ʼ��±�)��
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 | �ܽ��� |
�Ҷ��� | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������ | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
������ͼ��ʾ�������������ϸ����Һ�������ͷ������ܶ�Ӧ����( )

A. ���Dc�D��Һ B. ���Db�D���� C. ���Dd�D�����ᾧ D. ���Da�D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����Ҵ��Ĵ�����ʵ�飬�Թ�A��ʢ����ˮ�Ҵ���B��װ��CuO(��ʯ����������)����ش��������⣺

��1�����Թ�A�й��������Ŀ����______________________________________��
��2���Թ�A�ϲ�����ͭ˿��������______________________________��
��3���������пɹ۲쵽��������__________________����ػ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����˵����ȷ���ǣ� ��
A. ���ݶ����ЧӦ�ɽ���ɢϵ��Ϊ��Һ����������Һ
B. ����ˮ��Ͷ������������������������Ľ��壺Al3+��3H2O![]() Al(OH)3(����)��3H+
Al(OH)3(����)��3H+
C. Na+��K+��SO42-��Br-����Fe(OH)3�����������
D. ��ˮ�еμ���������FeCl3��Һ���γɴ���Ľ��壬����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵���������
A.�(D)ԭ�Ӻ�����1������B.H2O��D2O����ͬ��������
C.1H��D����ͬλ��D.1H218O��D216O����Է���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ȼ�����-����Ҫ�Ļ���ԭ�ϣ�������������ɫ�ж����壬����ˮ���������Ҵ���CCl4�ȡ�
(1)����ͬѧ��ʵ��������ͼ��ʾװ��ģ������Ʊ����ռ�һ�ȼ��顣����ˮZnCl2Ϊ������aƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______�����ʵ��ʱaƿ����ʱ�������������ƿ�õ�һ�ְ�ɫ���ʣ������ʵĻ�ѧʽ��__________��
��װ��B����Ҫ������___________��

(2)�ռ�����CH3Cl�����������г��ȼ�գ������ù�����![]() ��Һ������գ��Լ�����ָʾ������
��Һ������գ��Լ�����ָʾ������![]() �����Һ������Һ���еζ�(�����ķ�ӦΪ:NaOH+HCl=NaCl+H2O��Na2CO3+2HCl=2NaCl+CO2��+H2O)�����۲쵽___________ʱ���ﵽ�ζ��յ㣬����V2 mL���ᡣ�����ռ�CH3Cl�����ʵ���Ϊ____________mol. (��֪:
�����Һ������Һ���еζ�(�����ķ�ӦΪ:NaOH+HCl=NaCl+H2O��Na2CO3+2HCl=2NaCl+CO2��+H2O)�����۲쵽___________ʱ���ﵽ�ζ��յ㣬����V2 mL���ᡣ�����ռ�CH3Cl�����ʵ���Ϊ____________mol. (��֪: ![]() )
)
(3)����ͬѧѡ�ü���װ��A��B����ͼ��ʾ�IJ���װ�ü���CH3Cl�е���Ԫ�ء� (��֪��![]() )
)

������ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA.B��__��
��ͨ��һ��ʱ���CH3Cl���壬��װ��D�з�Һ©���Ļ����۲�ʵ������Һ©����ʢ�ŵ��Լ���________________��
����֤��CH3Cl�к�����Ԫ�ص�ʵ��������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ����(Te)�ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����֪��TeO2�������������ҵ�ϳ��á�ͭ�����ࡱ(��Ҫ��Cu2Te����������Ag��Au)Ϊԭ���Ʊ������ڣ��乤��������ͼ��ʾ��

�ش��������⣺
(1)�ڣ�Te��λ��Ԫ�����ڱ���_________���ڵ���A�壻�����й�ȷ�����ʵ������������______��
A.�ڵĵ����ڳ������ǹ�̬ B.�ڵij������ϼ���-2��+4��+6
C.�ڿ��������뵼����� D.�ڵ��⻯��H2Te���ȶ�
(2)ʵ�����С�����I����������________�������������ʵ������ص���________��
A.����©�� B.�ձ� C.��ƿ D.������ E.����ƿ
(3)�ڡ���ѹ��������������У�ÿ����1mol Cu2Te��Ӧ����TeOSO4��ת�Ƶĵ�����Ϊ________mol�����������Һ����������Ҫ�ɷֳ�TeOSO4�⣬������________��д��ѧʽ����
(4)����������ͭ��ʱ��������ø����Һ�����ڵ����У�ͭ��ȷ�����Ĺ�ϵ��ͼ��ʾ������ʼ�������ĵ缫��Ӧʽ��__________��

(5)����ȷ����ͭ��Һ����ͨ��SO2��ԭTeOSO4���ɰ��Ļ�ѧ����ʽΪ__________��
��������Ӧ�ڼ�������NaCl��Ӧ���ʴ���ȼӿ죬��NaCl����Ҫ����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۼ���ϩ��������(HEMA)��һ�������۾��ķ������ϣ��䵥��Ľṹ��ʽΪ��

�ش��������⣺
(1)д���ϳ�·����C4H8�Ľṹ��ʽ____________��д������ϵͳ����������___________��
(2)D�����к��еĹ���������Ϊ___________��
(3)��Ӧ�ڵ��Լ�������Ϊ___________����Ӧ�ݵķ�Ӧ����Ϊ___________��
(4)д����Ӧ�Ļ�ѧ����ʽ___________��
(5)д���ɵ���ϳɾۼ���ϩ����������HEMA���Ļ�ѧ����ʽ___________��
(6)д��ͬʱ��������������C��ͬ���칹�壺___________��
������NaHCO3��Һ��Ӧ�ų����� �ں˴Ź�����������3�����շ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ���ۻ�������һ�����й��ۼ������ܺ������Ӽ�
B. ���ӻ�������һ���������Ӽ������ܺ��й��ۼ�
C. ����״̬���ܵ��������һ�������ӻ�����
D. ֻ���зǽ���Ԫ�ص�����һ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com