
【题目】氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
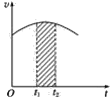
(1)反应开始时反应速率加快的原因是______________。
(2)反应后期反应速率下降的原因是______________。
(3)若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示______。
【答案】溶液中c(H+)增大,化学反应速率加快 H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢 t1~t2段时某一反应物浓度的减小值
【解析】
(1)开始时反应速率加快,下列因素能引起溶液中反应速率加快①增加浓度,②增压,③升温,④加正催化剂。联系题意可排除②④,由于题意中不涉及热量变化,故不需考虑③;接下来考虑①,但题中无外加物,所以只考虑c(H+)的变化,KClO3→Cl-,NaHSO3→SO32-+H++Na+,c(H+)增大,反应速率v增大;
(2)氢离子浓度增大,速率加快,则氢离子浓度减小,速率会减慢,亚硫酸氢钠会消耗生成的氢离子,故反应速率又减慢了;
(3) 若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示:t1~t2段时某一反应物浓度的减小值;
(1)2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4溶液中c(H+)增大,化学反应速率加快,
故答案为:溶液中c(H+)增大,化学反应速率加快;
(2)反应后期反应速率下降的原因是:氢离子浓度增大,速率加快,则氢离子浓度减小,速率会减慢, H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢,
故答案为:H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢;
(3)若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示:t1~t2段时某一反应物浓度的减小值,
故答案为:t1~t2段时某一反应物浓度的减小值;


科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容,引起了人们的研究兴趣。
(1)现有以下三种乙醇燃料电池(DEFC)。

①碱性乙醇燃料电池中,电极a上发生的电极反应式为____。
②酸性乙醇燃料电池中,电极b上发生的电极反应式为___。
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为___。
(2)0.4mol CuSO4和0.4molNaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为___L。
(3)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl难溶于水,广泛应用于电镀、印染等行业。工业上用辉铜矿(CuS2)为原料制取CuCl的一种流程图如下:

⑴写出“氧化Ⅰ”反应的离子方程式:______。
⑵写出“氧化Ⅱ”反应的离子方程式:_____。
⑶写出“还原”反应的离子方程式:______。
⑷将Cl2通入热的NaOH溶液,可以制得含NaClO3的溶液,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序数依次增大,
原子序数依次增大,![]() 与
与![]() 同主族但最高化合价不同,
同主族但最高化合价不同,![]() 是金属性最强的短周期元素。下列说法不正确的是( )。
是金属性最强的短周期元素。下列说法不正确的是( )。
A.简单离子半径:![]()
B.最高价氧化物对应水化物的酸性:![]()
C.化合物![]() 能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
D.![]() 的气态氢化物通入
的气态氢化物通入![]() 水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种太阳光电化学电池(![]() ),可不受限于白天或黑夜全天候地储存电能。该电池以硫酸为电解液,利用太阳能储存电能(充电)的原理如图(图中略去部分光电转换过程),下列说法不正确的是( )。
),可不受限于白天或黑夜全天候地储存电能。该电池以硫酸为电解液,利用太阳能储存电能(充电)的原理如图(图中略去部分光电转换过程),下列说法不正确的是( )。
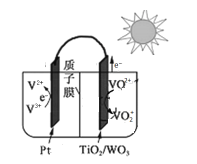
A.放电时,![]() 电极为负极
电极为负极
B.充电时,![]() 通过质子交换膜向
通过质子交换膜向![]() 电极迁移
电极迁移
C.放电时,负极的电极反应式为![]()
D.充电时,![]() /
/![]() 极的电极反应式为
极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如下,请回答相关问题:
![]()
Ⅰ.高锰酸钾的制备
(1)将![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,呈颗粒状后,再加强热
粉末,不断搅拌,呈颗粒状后,再加强热![]() 得墨绿色产物(
得墨绿色产物(![]() 为墨绿色固体),冷却。
为墨绿色固体),冷却。
①制![]() 反应的化学方程式为____。
反应的化学方程式为____。
②实验中使用的坩埚及搅拌棒的材质可以是________。
A.石英 B.瓷 C.刚玉(氧化铝) D.铁
(2)取出墨绿色产物研细,每次用![]() 4%的热
4%的热![]() 溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入
气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。滤液中的溶质除
在10~11之间,过滤。滤液中的溶质除![]() 外,还主要含有_____。
外,还主要含有_____。
(4)将滤液转入蒸发皿,小火加热,当看到________的现象时停止加热,冷却,________、________,干燥后得![]() 粗品。
粗品。

Ⅱ.高锰酸钾纯度的测定
(5)称取![]() 粗品,加入煮沸并冷却后的稀硫酸配成
粗品,加入煮沸并冷却后的稀硫酸配成![]() 溶液。量取
溶液。量取![]() 的草酸(
的草酸(![]() )溶液于锥形瓶中,用所配
)溶液于锥形瓶中,用所配![]() 溶液进行滴定。重复滴定两次,平均消耗
溶液进行滴定。重复滴定两次,平均消耗![]() 溶液的体积为
溶液的体积为![]() 。
。
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是________。
②滴定终点的标志是___________。
③![]() 纯度(质量分数)的计算式为________。
纯度(质量分数)的计算式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、R五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其基态原子的核外成对电子数是未成对电子数的3倍;R基态原子3d轨道上的电子数是4s轨道上的4倍。请回答下列问题:(答题时,X、Y、Z、W、R用所对应的元素符号表示)
⑴基态R原子的外围电子排布式为______;Y、Z、W的电负性由大到小的顺序是____。
⑵元素Y、Z均能与元素X形成含18个电子的微粒,这些微粒中沸点最高的是______,其沸点最高的原因是______;Y2X4难溶于X2W的原因是_____。
⑶YW的结构式为______(须标出其中的配位键);在化学式为[R(ZX3)4(X2W)2]2+的配离子中与R形成配位键的原子是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应______。
(2)由图可知,溶液酸性增大,CrO42-的平衡转化率____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com