
【题目】A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
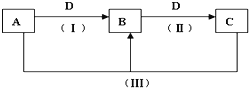
(1)若A、B、C的焰色反应均为黄色,A的水溶液能使酚酞溶液呈红色,C为发酵粉的主要成分之一,D的过度排放会造成温室效应。
①B的化学式为_____;
②反应Ⅲ的离子方程式是_______。
(2)写出Na2O2做防毒面具时涉及到的化学反应的化学方程式:____________、__________。
(3)写出Al(OH)3受热分解的化学方程式:__________。
【答案】Na2CO3 OH- + HCO3- = H2O + CO32- 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2Na2O2 + 2H2O = 4NaOH + O2↑ 2Al(OH)3 ![]() Al2O3 + 3H2O
Al2O3 + 3H2O
【解析】
(1)A、B、C的焰色反应均为黄色,说明含有Na元素,C为发酵粉的主要成分之一,C为NaHCO3,D的过度排放会造成温室效应,则D为CO2;则可以知道A为NaOH,B为Na2CO3。
(1)A、B、C的焰色反应均为黄色,说明含有Na元素,C为发酵粉的主要成分之一,C为NaHCO3,D的过度排放会造成温室效应,则D为CO2;则可以知道A为NaOH,B为Na2CO3。
①B为碳酸钠,化学是为Na2CO3;
②反应Ⅲ为NaOH与NaHCO3反应生成Na2CO3和水;离子方程式为OH-+HCO3-=CO32-+H2O;
(2)人呼出的气体中含有CO2和H2O,能够与Na2O2反应生成O2供氧;化学方程为
2Na2O2 + 2CO2 = 2Na2CO3 + O2,2Na2O2 + 2H2O = 4NaOH + O2↑;
(3)Al(OH)3受热分解得到氧化铝,化学方程式为2Al(OH)3 ![]() Al2O3 + 3H2O。
Al2O3 + 3H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()
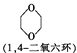
A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式__________,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为_______。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2![]() 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si![]() Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
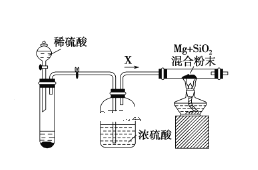
(2)由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.Na2SO3 b.锌粒 c.纯碱
(3)实验开始时,必须先通入X气体,再加热反应物,其理由是________,当反应开始后,移走酒精灯反应能继续进行,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重晶石(主要成分为BaSO4)制备BaCO3的常用方法有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单表示如下:
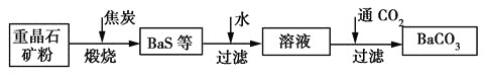
(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为_____________。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是________。
a 加入过量的焦炭,同时通入空气
b 设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是________。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+![]() (aq)BaCO3(s)+
(aq)BaCO3(s)+![]() (aq)
(aq)
①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为_________。
②与高温煅烧还原法相比,沉淀转化法的优点主要有_______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是人类进步的关键”。下列说法不正确的是 ( )
A.PM2.5是指空气中直径≤2.5 μm的固体颗粒或液滴的总称
B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
D.![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液 B、升华 C、降温结晶 D、分液 E、蒸馏 F、过滤
①____分离饱和食盐水与沙子的混合物;
②____从硝酸钾和氯化钠的混合液中获得硝酸钾;
③____分离水和汽油的混合物;
④____分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃);
⑤____分离出混在沙土中的碘单质。
(Ⅱ)掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。

(1)写出下列仪器的名称:a.___;b___
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由___(填f或g)口通入___(填f或g)流出。
(3)实验时a中除加入少量自来水外,还需加入少量___,其作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:______________,该反应中,Na2O2的作用为____________(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。
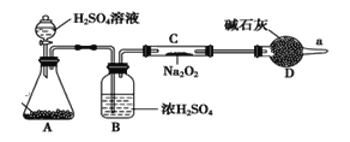
①装置A的名称是_______,A中的固体为_________,装置B中试剂的作用为______
②若Na2O2能与CO2,则装置C中的现象是____________
(3)无水氯化钙是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要_______________。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:SO32-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________________(填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________________。
②上述实验中,W与足量氯水反应的离子方程式为_________________________________________________________。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为___________________。
②1mol W与足量水充分反应,转移电子的物质的量为_____________mol。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为______________________________。
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为______________________;
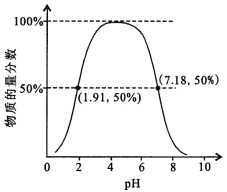
该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈______________________。
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com