
【题目】下列物质属于非电解质的是( )
A.NH4Cl
B.Al
C.AlCl3
D.NH3
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是
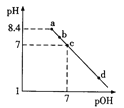
A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)=c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾的化学式可表示为FeSO4·xH2O,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的某些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液颜色无明显变化。充分振荡后,溶液逐渐变红。溶液变红的原因是_________(用离子方程式表示)。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①下列实验操作步骤的正确排序为___________________(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.关闭K1和K2 b.打开K1和K2,缓缓通入N2 c.点燃酒精灯,加热 d.称量A e.冷却到室温 f.熄灭酒精灯
②判断A是否恒重的方法是____________________。
③根据实验记录,绿矾化学式中结晶水数目x=________________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入由下图所示仪器组装而成的装置中,打开K1和K2,缓缓通入N2一段时间后,加热。实验后反应管中残留固体为红色粉末。
①反应中有两种气体产物生成,为检验该气体混合物的组成,请从下图所示的仪器中,选择合适的仪器(含其中的试剂),组成一套实验装置,该装置的连接顺序(按气体流向从左到右)依次为___________→D(填装置序号)。装置中除有气泡冒出外,其他证明实验结论的现象分别为__________________________。

②硫酸亚铁高温分解的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A. 用加水溶解、过滤、洗涤、烘干的方法除去 MnO2 固体中的 KCl
B. 用蒸馏的方法分离汽油和水的混合物
C. 用酒精萃取溴水中的溴单质
D. 用过滤的方法除去 NaCl 溶液中含有的少量淀粉胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A. H2Y电离方程式为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B. 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 常温下,酸式盐NaHY 的水溶液呈酸性
D. HY-的水解方程式为:HY-+ H2O![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度下等物浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
(2)25℃。向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。己知该温度下AgCl的Ksp=l. 0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=_____________。
②完全沉淀后,溶液的pH=____________。
(3)弱酸及其盐在水中存在多种平衡关系。己知NaA水溶液呈碱性,常温下将0.lmolNaA和0.05molHCl溶于水,得到1L溶液。
①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为____________。
②向该混合物中再加0.03molNaOH,溶液中n(A-) +n(OH-)-n(H+) =____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com