
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时正极反应为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-
B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH-
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.标有“+”的接线柱充电时作阳极,放电时作正极
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
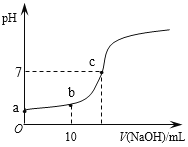
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对核外电子运动状况的描述正确的是( )
A.当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,这一过程中释放能量
时,这一过程中释放能量
B.电子在钠原子的核外空间运动状态有11个
C.同一原子中,![]() ,
,![]() ,
,![]() 能级的轨道依次增多
能级的轨道依次增多
D.在同一能级上运动的电子,其运动状态可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
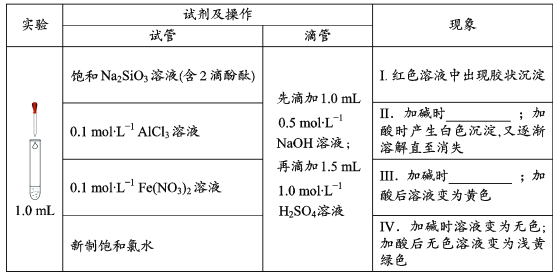
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:___。
(2)Ⅱ中加碱时出现的现象是___,此现象说明溶液中发生反应的离子方程式是___。
(3)Ⅲ中加碱时出现的现象是___。
(4)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。

①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL0.1mol/LFe(NO3)2溶液中__,溶液立即变血红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol/LFe(NO3)2溶液中的Fe2+被NO3-氧化;
b.__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,下列关于实验现象的描述正确的是( )
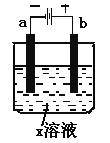
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 °C时,MOH的Kb=10-7。该温度下,在20.00 mL0.1 mol· L-1 MCl溶液中滴入0.1 mol·L-1NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法错误的是
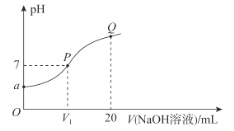
A.a=4B.V1=10
C.溶液中水的电离程度:P>QD.Q点溶液中c(Na+)<2c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物 a(![]() )、b(
)、b(![]() ) 、c(
) 、c(![]() )的说法正确的是
)的说法正确的是
A.a、b 互为同系物
B.C 中所有碳原子可能处于同一平面
C.b 的同分异构体中含有羧基的结构还有 7 种(不含立体异构)
D.a 易溶于水,b 、c 均能使酸性高猛酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种形状酷似一条小狗的有机物,化学家 Tim Rickard 将其取名为“doggycene”,有关 doggycene的说法正确的是( )
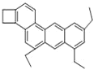
A.该有机物属于苯的同系物
B.“doggycene”可以使溴水褪色
C.该物质常温下为气态
D.1mol 该物质在氧气中完全燃烧生成 CO2 和水物质的量之比为 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展了一系列的化学实验活动。
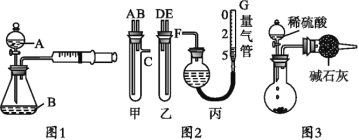
请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是_____。
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于___、__仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是___;
③仪器甲、乙接口的连接方式如下:A连接__,B连接___,C连接___(填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差___,请你分析其中使测定结果可能偏大的主要原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com