
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
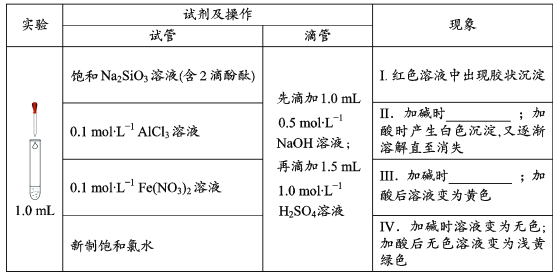
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:___。
(2)Ⅱ中加碱时出现的现象是___,此现象说明溶液中发生反应的离子方程式是___。
(3)Ⅲ中加碱时出现的现象是___。
(4)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。

①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL0.1mol/LFe(NO3)2溶液中__,溶液立即变血红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol/LFe(NO3)2溶液中的Fe2+被NO3-氧化;
b.__。
【答案】2H++SiO32-═H2SiO3↓ 出现白色沉淀,又逐渐溶解直至消失 Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O 生成白色沉淀迅速变成灰绿色,最后变成红褐色 滴加KSCN溶液 亚铁离子被空气中的氧气氧化
【解析】
(1)用离子方程式解释现象I中出现胶状沉淀的原因是硅酸钠和硫酸反应生成硅酸沉淀,反应的离子方程式为:2H++SiO32-═H2SiO3↓,故答案为:2H++SiO32-═H2SiO3↓;
(2)1ml 0.1molL-1AlCl3溶液中先滴加1.0mL0.5molL-1NaOH溶液:再滴加1.5mL1.0molL-1H2SO4溶液,计算物质的量可知氢氧化钠物质的量为0.0005mol,铝离子物质的量为0.0001mol,Al3++3OH-=Al(OH)3↓,碱过量生成氢氧化铝会随氢氧化钠滴入溶解得到偏铝酸钠溶液,Al(OH)3+OH-=AlO2-+2H2O,生成AlO2-物质的量=0.0001mol,剩余0.0001molNaOH,沉淀消失,再滴加1.5mL1.0molL-1H2SO4溶液,溶液中氢离子物质的量=0.0015L×1.0mol/L×2=0.003mol,滴入硫酸溶液先中和氢氧根离子,偏铝酸根离子结合氢离子生成氢氧化铝沉淀,发生反应H++OH-=H2O,AlO2-+H++H2O=Al(OH)3↓,硫酸过量继续滴入生成的氢氧化铝会全部溶解,故答案为:出现白色沉淀,又逐渐溶解直至消失;
(3)0.1molL-1Fe(NO3)2溶液中滴入先滴加1.0mL0.5molL-1NaOH溶液:再滴加1.5mL1.0molL-1H2SO4溶液,生成氢氧化亚铁白色沉淀迅速变化为灰绿色最后变化为红褐色沉淀,故答案为:生成白色沉淀迅速变成灰绿色,最后变成红褐色;
(4)①向1.0mL 0.1molL-1Fe(NO3)2溶液中滴加KSCN溶液,没有明显现象,再向其中滴加1.5 mL 1.0 molL-1H2SO4溶液,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应,故答案为:滴加KSCN溶液;
②溶液中硝酸根离子在酸溶液中具有氧化性能氧化亚铁离子是铁离子,空气中的氧气会也会亚铁离子生成铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,故答案为:亚铁离子被空气中的氧气氧化。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O = 2Fe2+ + 4SO42 + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ中Fe(NO)2+作氧化剂
B.在酸性条件下,黄铁矿催化氧化中NO作中间产物
C.由反应Ⅱ可知,氧化性:Fe3+>SO42
D.反应Ⅲ的离子方程式为Fe2+ + NO =Fe(NO)2+,该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
选项 | A | B | C | D |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | KSCN溶液滴入FeCl3溶液中 | CO2通过装有Na2O2固体的干燥管 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 溶液变为红色 | 固体由淡黄色变为白色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。![]() 是宇宙中最丰富的元素;
是宇宙中最丰富的元素;![]() 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含
元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含![]() 的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能![]() ____
____![]() ,电负性
,电负性![]() ____
____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)写出与![]() 分子互为等电子体的一种离子的化学式_________。
分子互为等电子体的一种离子的化学式_________。
(3)若向含有![]() 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
(4)已知![]() 形成的一组二元化合物化学式:
形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中
分子中![]() 原子的杂化类型为___________;这组化合物的通式为________________。
原子的杂化类型为___________;这组化合物的通式为________________。
(5)已知![]() 和
和![]() 可以形成
可以形成![]() 和
和![]() 两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
①用球棍模型表示的![]() 分子结构是_______________。
分子结构是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.
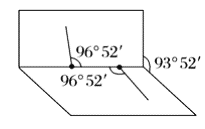
②已知![]() 子的结构如图所示:
子的结构如图所示:![]() 分子不是直线形的,两个
分子不是直线形的,两个![]() 原子犹如在半展开的书的两面上,两个
原子犹如在半展开的书的两面上,两个![]() 原子在书脊位置上,书页夹角为
原子在书脊位置上,书页夹角为![]() ,而
,而![]() 键与
键与![]() 键的夹角均为
键的夹角均为![]() 。则
。则![]() 子的电子式为_________,结构式为_________,
子的电子式为_________,结构式为_________,![]() 分子是_______(填“极性”或“非极性”)分子。
分子是_______(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M( )是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
)是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
A.所有原子不可能处于同一平面
B.可以发生加聚反应和缩聚反应
C.与 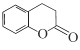 互为同分异构体.
互为同分异构体.
D.1 mol M最多能与1mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时正极反应为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-
B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH-
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.标有“+”的接线柱充电时作阳极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,下列关于新型镁锂双离子二次电池的说法不正确的是
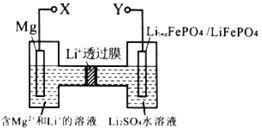
A.充电时,外加电源的正极与 Y 相连
B.充电时,导线上每通过 lmole—,理论上左室电解液质量减轻12 g
C.放电时,Li十由左向右移动
D.放电时,正极的电极反应式为 Li1- xFePO4 +xLi ++xe—=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com