
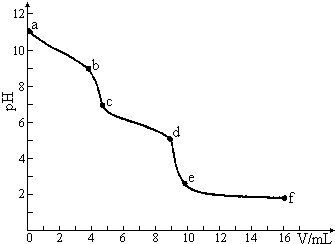
 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
分析 A.碳酸钠是强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,但水解程度较小;
B.pH=7,溶液呈中性,则[H+]=[OH-],结合电荷守恒判断;
C.pH=6时,溶液呈酸性,溶液中的溶质为氯化钠、碳酸氢钠和碳酸,且碳酸的电离程度大于碳酸氢钠的水解程度;
D.c→d时,碳酸氢根离子和氢离子发生离子反应生成水和二氧化碳.
解答 解:A.碳酸钠是强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,但水解程度较小,所以氢氧根离子浓度小于碳酸钠浓度,则碳酸钠溶液的浓度大于0.001mol•L-1,故A错误;
B.pH=7,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),则c(Na+)>c(Cl-),故B错误;
C.pH=6时,溶液呈酸性,溶液中的溶质为氯化钠、碳酸氢钠和碳酸,且碳酸的电离程度大于碳酸氢钠的水解程度,所以c(HCO3-)>c(CO32-),且钠离子不水解,结合物料守恒得钠离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-),故C正确;
D.c→d时,碳酸氢根离子和氢离子发生离子反应生成水和二氧化碳,离子反应方程式为:HCO3-+H+=H2O+CO2↑,故D错误;
故选C.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键,试题培养了学生的灵活应用能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HD、CaCl2、NaOH、HCl四种物质都属于化合物 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 金属氧化物不一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| D. | 金属单质只能做还原剂,非金属单质只能做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤① | B. | ②③①④⑤ | C. | ①②③④⑤ | D. | ②①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com