
【题目】关于热化学方程式CO(g)+![]() O2(g)=CO2(g) H=-283kJmol-1,下列说法正确的是
O2(g)=CO2(g) H=-283kJmol-1,下列说法正确的是
A.一氧化碳和氧气反应放出283 kJ热量
B.1 mol CO和0.5 mol O2反应生成1 mol CO2吸收283 kJ热量
C.2 mol CO(g)和1 mol O2(g)反应生成2 mol CO2(g)时放出566 kJ热量
D.1个CO分子和0.5个O2分子反应吸收283 kJ热量
科目:高中化学 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
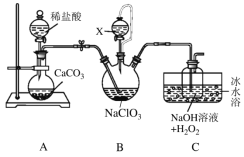
已知:①ClO2沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl。
③B装置为ClO2发生装置,所用试剂NaClO3、H2SO4(浓)、CH3OH。
请回答下列问题:
(1)装置B中试剂X的名称为___________;盛放该试剂的仪器的名称为________________。
(2)实验过程中需持续通入一定量的CO2,其目的是______________;反应结束后需再通入一定量的CO2,其目的是_____________________。
(3)装置C中的水浴温度应控制在____________________(填温度范围);装置C中生成NaClO2的离子方程式为___________________。
(4)上述装置存在一处明显的缺陷,其改进措施为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铜-锌原电池示意图。下列有关该原电池的描述中正确的是( )

A.锌片作正极,不断溶解
B.铜片作负极,有气泡产生
C.负极反应:Zn2++2e-=Zn
D.正极反应:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在25℃、 101 kPa时),CH4、C2H4 在高温条件还会分解生成炭与氢气:
①C (s) +2H2(g)![]() CH4(g) △H1=-74.85kJmol-1
CH4(g) △H1=-74.85kJmol-1
②2CH4(g)![]() C2H4(g) +2H2(g) △H2=340.93kJmol-1
C2H4(g) +2H2(g) △H2=340.93kJmol-1
③C2H4(g)![]() C2H2(g) +H2(g) △H3=35.50kJmol-1
C2H2(g) +H2(g) △H3=35.50kJmol-1
请回答:
(1)依据上述反应, 请写出 C 与 H2化合生成 C2H2 的热化学方程式:______________。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________。
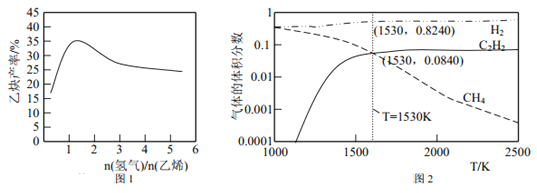
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在1530℃之前随温度升高而增大的原因可能是_______________;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530℃时测得气体的总物质的量为1.000 mol,则反应C2H4(g)![]() C2H2(g) +H2(g) 的平衡常数 K=_______________。
C2H2(g) +H2(g) 的平衡常数 K=_______________。
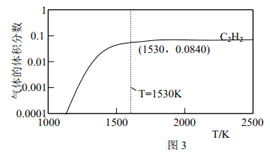
③请在图3中绘制乙烯的体积分数和反应温度的关系曲线__________。
(二)当今,人们正在研究有机锂电解质体系的锂-空气电池,它是一种环境友好的蓄电池。放电时电池的总反应为:4Li+O2===2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可的是按两步进行,请补充完整。电极反应式: ________________________和 Li2O2-2e-=2Li++O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )

A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以石油为原料的部分转化流程:
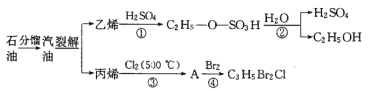
已知:C2H5Br+NaOH![]() C2H5OH+NaBr(水解反应)
C2H5OH+NaBr(水解反应)
(1)反应①的类型是_________,由乙烯制备乙醇的过程中,硫酸起________作用;
(2)已知A的分子式为C3H5Cl,则A的结构简式为___________;
(3)C3H5Br2Cl与NaOH水溶液完全反应生成有机产物X,则1molX与足量的Na单质反应可生成标况下_________L氢气;
(4)写出丙烯通入溴的CCl4溶液中发生反应的化学方程式:______________________。
(5)相对分子质量为72且沸点最低的烷烃的结构简式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com