
【题目】某运动员比赛后化验,体液中Ca2+含量太低,导致神经和肌肉的兴奋性过高而出现抽
搐。这一事实说明Ca2+的生物功能之一是 ( )
A. 构成细胞结构的主要成分之一 B. 维持细胞的正常形态
C. 维持细胞的正常生理功能 D. 调节渗透压和酸碱平衡
科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( ) 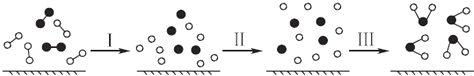
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )
A. HCN B. CH3COOH C. HF D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如图: 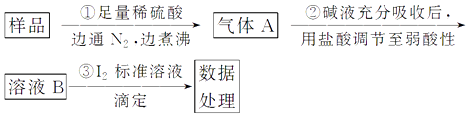
(1)碘标准液应选用(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行、洗涤、润洗.
(2)锥形瓶内的指示剂为 , 判断达到滴定终点的依据 .
(3)下列操作会使测定结果偏大的有
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品wg,按乙方案测得消耗0.010molL﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。

已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
(1)写出四种元素的元素符号:W________;X________;Y________;Z________。
(2)四种元素的所有化合价中,最低负化合价为________价,最高正化合价为________价。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为________;化合物乙是一种常见的化肥,其化学式为________。
(4)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)试剂X为____________________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________。
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________;重复滴定,实验数据记录如下:
滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为____________________。(ICl3相对分子质量为233.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨溴索(H)对于治疗老年重症肺炎有良好的疗效,其合成路线如下(部分反应条件及产物已略):
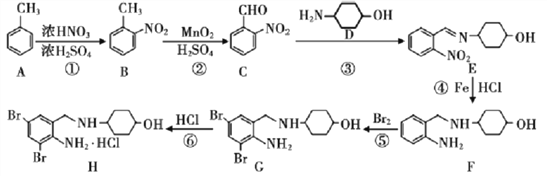
(1)B的名称为_________;反应①-⑥中为取代反应的是___________(填序号)。
(2)B的芳香族同分异构体J满足下列条件:
①可水解 ②可发生银镜反应 ③1mol J最多消耗2mol NaOH
J有________种;B的另一种芳香族同分异构体可与NaHCO3溶液反应,并有气体生成,其核磁共振氢谱有4组吸收峰,则它的结构简式为____________。
(3)可用碱性新制氢氧化铜悬浊液检验C中的特征官能团,写出该检验的离子反应方程式:____________________________。
(4)关于E的说法正确的是_________。
A.E难溶于水 B.E可使酸性KMnO4溶液褪色
C.1molE最多与1molH2加成 D.E不能与金属钠反应
(5)邻氨基苯甲酸甲酯(L)具有塔花的甜香味,也是合成糖精的中间体,以甲苯和甲醇为原料,无机试剂自选,参照H的合成路线图,设计L的合成路线____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com