
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4-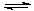 H++ SO42-用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
H++ SO42-用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含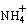 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O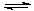 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+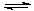 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
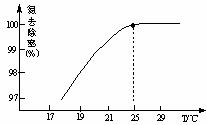 ①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
科目:高中化学 来源: 题型:
下列离子方程式,一定正确的是( )
A.亚硫酸钠与稀硝酸反应SO32-+2H+=SO2↑+H2O
B.氢氧化钡中加入稀硫酸: H++OH— = H2O
C.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
D.将少量SO2气体通入Ca(ClO)2溶液中SO2+Ca2++2ClO-+H2O=CaSO3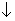 +2HClO
+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述中,合理的是( )
①用pH试纸测得某新制氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
A. ②④⑥ B. ②③⑥ C. ①②④ D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中曲线变化正确的是( )
A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示AgNO3溶液中滴入氨水
D.④表示一定条件下2SO2+O2 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:4A(g)+5B(g)= 4C(g)+6D(g)在不同条件下进行,用不同的物质表示其反应速率如下,则此反应在不同条件下进行最快的是:
A.v(A)=2 mol•L﹣1•min﹣1
B.v(B)=3 mol•L﹣1•min﹣1
C.v(C)=1 mol•L﹣1•min﹣1
D.v(D)=0.04 mol•L﹣1•s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论错误的是( )
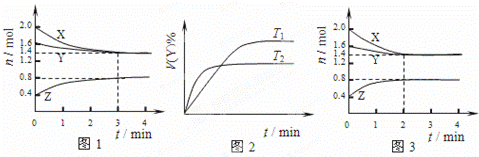
|
| A. | 容器中发生的反应可表示为:3X(g)+Y(g) |
|
| B. | 反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L•min) |
|
| C. | 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
|
| D. | 保持其他条件不变,升高温度,化学平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M
最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
 (2)XZ
(2)XZ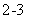 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ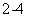 ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,
其晶胞结构如图所示,则该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:

(1)待测液中是否含有SO42-、SO32-:_____________________ 。
(2)沉淀B的化学式为_________;生成沉淀B的离子方程式为
___________________ __。
(3)根据以上实验,待测液中肯定没有的离子是___________________; 肯定存在的离子还有________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com