
【题目】过氧化氢的水溶液俗称双氧水,它的用途很广,常用于消毒、杀菌、漂白等.试回答下列问题:
(1)过氧化氢属于(极性/非极性)分子.
(2)Na2O2 , K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经操作即可制得,则上述最适合的过氧化物是 .
(3)几乎所有古代艺术家的油画都是以铅白2PbCO3Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式: .
(4)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%﹣70%的过氧化氢溶液中,①则该反应的化学方程式为 , ②过氧化氢比理论用量稍多,其目的是 . ③反应温度最好控制在30﹣70℃,温度不易过高,其主要原因是 .
(5)图2是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为 .
(6)过氧化氢与碳酸钠的加合物 Na2CO3xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100g Na2CO3xH2O2晶体加热,实验结果如图1所示,则该晶体的组成为 .
【答案】
(1)极性
(2)过滤;BaO2
(3)2PbCO3?Pb(OH)2+3H2S=3PbS+2CO2+4H2O
(4)Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑;使甲醛充分氧化,提高甲醛的利用率和产品纯度;防止H2O2分解和甲醛挥发
(5)BH4﹣﹣8e﹣+8OH﹣=BO2﹣+6H2O
(6)Na2CO3?1.5H2O2
【解析】解:(1)根据双氧水的结构可知,双氧水中每个氧原子有2对孤电子对,双氧水分子中电荷分布不均匀,是极性分子;所以答案是:极性;(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;所以答案是:过滤;BaO2;(3)铅白2PbCO3Pb(OH)2与H2S气体反应生成黑色的硫化铅,反应的化学方程式为2PbCO3Pb(OH)2+3H2S=3PbS+2CO2+4H2O,所以答案是:2PbCO3Pb(OH)2+3H2S=3PbS+2CO2+4H2O;(4)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%﹣70%的过氧化氢溶液中,Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑,化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度;温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30﹣70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发;所以答案是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑;使甲醛充分氧化,提高甲醛的利用率和产品纯度;防止H2O2分解和甲醛挥发;(5)如图负极是BH4﹣流向的一极,同时生成BO2﹣ , 发生氧化反应反应,电极反应式为BH4﹣﹣8e﹣+8OH﹣=BO2﹣+6H2O,所以答案是:BH4﹣﹣8e﹣+8OH﹣=BO2﹣+6H2O;(6)2Na2CO3xH2O2 ![]() 2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所的固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为
2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所的固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为 ![]() ×100%=1﹣67.6%,解得x=1.5,化学式为:Na2CO31.5H2O2 ,
×100%=1﹣67.6%,解得x=1.5,化学式为:Na2CO31.5H2O2 ,
所以答案是:Na2CO31.5H2O2 .
【考点精析】解答此题的关键在于理解极性分子和非极性分子的相关知识,掌握非极性分子中整个分子电荷分布是均匀的、对称的;极性分子中整个分子的电荷分布不均匀,不对称.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质分类的组合正确的是( )
碱性氧化物 | 碱 | 盐 | |
A | 氧化钠 | 纯碱 | 氯化铝 |
B | 生石灰 | 烧碱 | 明矾 |
C | 熟石灰 | 苛性钠 | 硫酸铜 |
D | 过氧化钠 | 氢氧化钙 | 小苏打 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.6 mol·L-1氢氧化钠溶液,含氢氧化钠的物质的量为 ( )
A. 0.03 mol B. 0.04 mol C. 0.05 mol D. 0.06 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把①蔗糖、②淀粉、③蛋白质、④油脂在稀酸存在的条件下分别进行水解,最后只得到一种产物的是( )
A. ①和② B. ② C. ②③和④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氟、氯、溴、碘的下列说法中,错误的是( )
A. 它们最外层电子数都是7 B. 原子核外电子层数依次增多
C. 原子半径依次减小 D. 原子核对最外层电子的引力依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子为( )
A.6 molB.2 molC.3 molD.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,78g苯中含有碳氢键的数目为6NA
B.180g乙酸、葡萄糖的混合物所含碳原子数为6NA
C.1L0.1molL﹣1Na2S溶液中阴离子总数大于0.1NA
D.在密闭容器中通入3molH2和1molN2 , 充分反应后得到的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
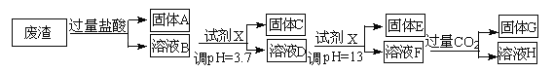
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com