
【题目】利用海洋资源可以获得很多物质![]() 如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
![]() 一
一![]() 从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的
从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的![]() 、
、![]() 、
、![]() .
.
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______
a.先加 NaOH,后加Na2 CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2 CO3
C.先加BaCl2,后加NaOH,再加Na2 CO3
(2)判断试剂BaCl2己经足量的方法是______________________。
![]() 二
二![]() 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在![]() 实验室里从海带中提取碘的流程如下:
实验室里从海带中提取碘的流程如下:
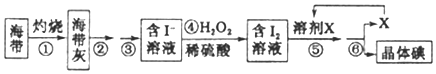
(1)实验时灼烧海带应在______________(填仪器名称)内进行
(2)步骤④中反应的离子方程式是_______________________________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是_____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
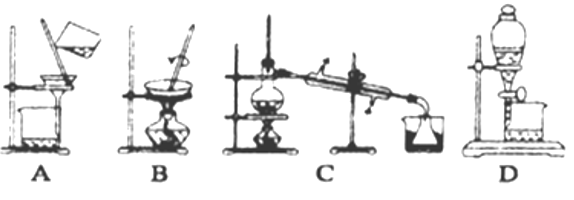
(4)步骤⑥的实验操作应选用如图中的______。
【答案】bc 静置,在上层淸液中滴加BaCl2溶液,若不再产生白色沉淀,则BaCl2己足量 坩埚 2I+H2O2+2H+=I2+2H2O )萃取分液 b C
【解析】
(二)海带在坩埚中灼烧得到海带灰,溶于水过滤得到含碘离子的溶液,加入过氧化氢氧化碘离子生成碘单质,加入萃取剂萃取分液得到含碘单质的四氯化碳溶液,蒸馏得到碘单质,萃取剂循环使用。
(一)(1)先加入过量的氢氧化钠可以除去镁离子,加入氯化钡可以除去硫酸根离子,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡,(注意碳酸钠必须加在氯化钡的后面)最后加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠,所以选bc;
(2)判断试剂BaCl2己经足量的方法是:静置,在上层淸液中滴加BaCl2溶液,若不再产生白色沉淀,则BaCl2己足量;
(二)实验时灼烧海带应在坩埚中灼烧;
(2)步骤④中反应是过氧化氢氧化碘离子生成碘单质,反应的离子方程式是:2I++H2O2+2H+=I2+2H2O;
(3)步骤⑤的实验操作为萃取分液,溶剂X需要满足不溶于水,碘单质在其中溶解性大于水中,可以是b四氯化碳或苯,a和c中的酒精易溶于水不能做萃取剂;
(4)步骤⑥的实验操作是利用物质沸点不同蒸馏的方法分离混合物,选C。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.向NaHCO3溶液中加入醋酸:HCO3-+CH3COOH =CO2↑+H2O+CH3COO-
C.乙醛与新制的碱性氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+2OH-![]() CH3COO-+2CuO↓+3H2O
CH3COO-+2CuO↓+3H2O
D.苯酚浊液中滴加碳酸钠溶液:2![]() +Na2CO3 =2
+Na2CO3 =2![]() +CO2 +H2O
+CO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型二次电池工作原理:2K2S2+KI3![]() K2S4+3KI,装置如图所示。下列说法正确的是( )
K2S4+3KI,装置如图所示。下列说法正确的是( )
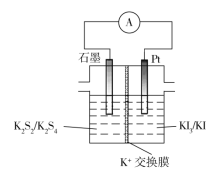
A.放电时,电子由铂极经外电路流向石墨极
B.放电时,负极的电极反应式为2S22--2e=S42-
C.充电时,铂极的电极反应式为I3-+2e-=3I-
D.充电时,若电路中有2mol电子转移,则有2molK由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,![]() 含有的氧原子数为3 NA
含有的氧原子数为3 NA
B.标准状况下,![]() 与足量的
与足量的![]() 反应转移的电子数为3 NA
反应转移的电子数为3 NA
C.NA个一氧化碳分子和![]() 甲烷的质量比为7:4
甲烷的质量比为7:4
D.![]() 固体溶于1L的水中,所得溶液的物质的量浓度为
固体溶于1L的水中,所得溶液的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具![]() 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是![]()
![]()
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5mol
C.每生成1molFe3O4,反应转移的电子为4mol
D.O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入 | 该溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜酸钾晶体{K2[Cu(C2O4)2]·2H2O)(相对分子质量为354),微溶于水和酒精,可溶于氨水,在干燥的环境下较为稳定。现以胆矾和草酸(H2C2O4)为原料制备二草酸合铜酸钾晶体的流程如下:
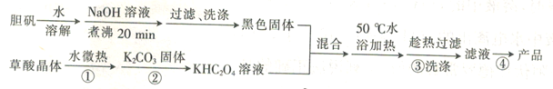
回答下列问题:
(1)K2[Cu(C2O4)2]·2H2O中Cu的化合价为___________。
(2)在常温下,胆矾溶液与氢氧化钠溶液反应生成氢氧化铜,当所得溶液的pH=7时,则溶液中c(Cu2+)=_________{已知该温度下Ksp[Cu(OH)2]=2.2×10-20}。
(3)黑色固体的化学式为__________________,过滤时用到的玻璃仪器有漏斗、__________。
(4)草酸晶体受热易分解,产物为CO、CO2和H2O,该反应的化学方程式为_____________。
(5)操作④后得到的晶体需用少量酒精洗涤,其目的是_________。
(6)产品的定量准确称取2.000 g样品溶于氨水中,并配成250 mL溶液,量取25.00 mL溶液于锥形瓶中,再加入10 mL 3.000 mol·L-1稀硫酸,用0.01000 mol·L-1KMnO4标准液滴定。
①若消耗KMnO4标准液的体积为20.00 mL,则该产品的纯度是__________。
②滴定过程中如果盛装标准液的滴定管没有润洗,则测得的结果将_______(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com