
【题目】某新型二次电池工作原理:2K2S2+KI3![]() K2S4+3KI,装置如图所示。下列说法正确的是( )
K2S4+3KI,装置如图所示。下列说法正确的是( )
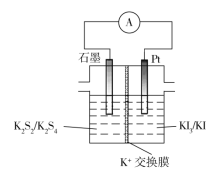
A.放电时,电子由铂极经外电路流向石墨极
B.放电时,负极的电极反应式为2S22--2e=S42-
C.充电时,铂极的电极反应式为I3-+2e-=3I-
D.充电时,若电路中有2mol电子转移,则有2molK由交换膜左侧向右侧迁移
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将少量溴水加入KI溶液中,再加入CCl4,振荡静置,可观察到下层液体呈紫色,证明Br2的氧化性强于I2
B.SO2能使紫色酸性高锰酸钾溶液褪色,证明SO2具有漂白性
C.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如右图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.充电时,电池的甲电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如图。
I
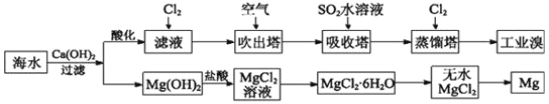
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是______,吸收塔中发生反应的离子方程式是__________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是____、浓缩、冷却、______、过滤、洗涤、干燥。
II以食盐为原料进行生产并综合利用的某些过程如图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO![]() 离子,加入下列沉淀剂的顺序是(填序号)____。
离子,加入下列沉淀剂的顺序是(填序号)____。
a.BaCl2 b.Na2CO3
(2)NaHCO3制取Na2CO3化学方程式是_____。
(3)将滤液的pH调至酸性除去的离子是______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是_____。
(5)工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是_______。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法转化CO2可实现CO2资源化利用,现电解CO2制HCOOH的原理示意图如图所示。下列说法不正确的是
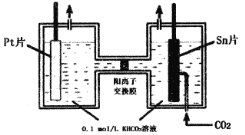
A.Sn片与电源负极相连,用多孔锡电极代替普通Sn片更好
B.右池电极方程式为:H2O+2CO2+2e+=HCOO-+HCO3-
C.左池中H2O发生电解生成O2,从而使该池中KHCO3溶液浓度升高
D.溶液中,K+从左池通过阳离子交换膜移向右池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源可以获得很多物质![]() 如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等.
![]() 一
一![]() 从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的
从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2 CO3、③NaOH、④BaCl2来除去食盐水中的![]() 、
、![]() 、
、![]() .
.
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______
a.先加 NaOH,后加Na2 CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2 CO3
C.先加BaCl2,后加NaOH,再加Na2 CO3
(2)判断试剂BaCl2己经足量的方法是______________________。
![]() 二
二![]() 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在![]() 实验室里从海带中提取碘的流程如下:
实验室里从海带中提取碘的流程如下:
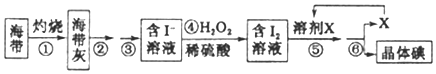
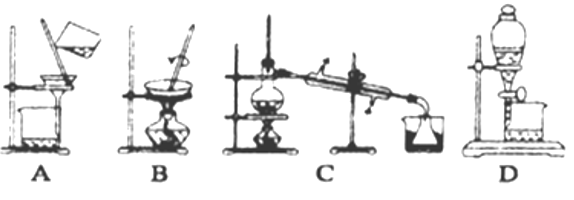
(1)实验时灼烧海带应在______________(填仪器名称)内进行
(2)步骤④中反应的离子方程式是_______________________________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是_____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
(4)步骤⑥的实验操作应选用如图中的______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质C为对甲氧基苯丙酰胺(相对分子质量为179)难溶于冷水的白色晶体,是一种医药中间体,可以由苯甲醚通过两步合成,如下图所示:
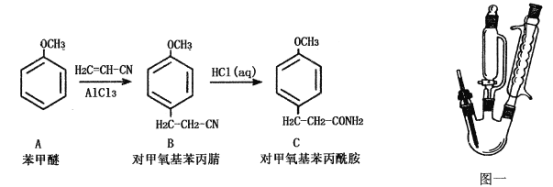
已知:无水三氯化铝遇水会发生强烈水解并放热。
①步骤一:用图一装置合成对甲氧基苯丙腈(B)
在500 mL三颈烧瓶中,加入108 g(1.00 mol)苯甲醚(A),室温下缓慢加入70g(0.52 mol)粉末状三氯化铝,加入过程中温度不超过25℃,加完后降温至5℃,逐滴加入130g(2.45 mol)丙烯腈,滴加结束后再升温至90~95℃,反应2小时。将反应物倒入500g冰水中,搅匀,静置分层,分出油相。减压蒸馏,收集150~160℃/2.67kPa馏分,得到对甲氧基苯丙腈。
②步骤二:对甲氧基苯丙酰胺(C)的合成
将上述反应合成的对甲氧基苯丙腈加入到500 mL三颈烧瓶中,加入300 mL浓盐酸,再经过一系列操作后得对甲氧基苯丙酰胺133.7g。
(1)对甲氧基苯丙腈(B)的合成过程中宜采用的加热方式:____________
(2)图一中合成对甲氧基苯丙腈(B)的装置有一缺陷,请提出改进方法并说明理由:_________
(3)用恒压滴液漏斗加丙烯腈的优点:___________________________________(写出两条);
(4)下列操作为步骤二对甲氧基苯丙酰胺(C)合成过程中加浓盐酸后的一系列操作,请排出下列操作的合理顺序:____________________________________;
①加入活性炭回流0.5h ②趁热过滤 ③抽滤 ④将滤液慢慢倒入1000g冷水中,析出晶体⑤升温至40~50℃,搅拌1h ⑥洗涤、烘干
(5)下列关于实验操作的说法错误的是:__________
A.减压蒸馏采用如图二所示装置,装置中的D为毛细管,也可以用沸石代替
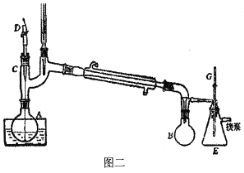
B.减压蒸馏过程中,可以通过控制G处的旋塞停止减压
C.在步骤二,对甲氧基苯丙酰胺(C)的合成过程中,析出的晶体可以用冷水洗涤
D.在步骤二,抽滤后洗涤晶体时,应先关小水龙头,使洗涤剂浸没晶体后,再打开水龙头进行抽滤
E.减压过滤不宜用于过滤颗粒太小的沉淀,因为颗粒太小的沉淀在快速过滤时易透过滤纸
(6)本实验制得的对甲氧基苯丙酰胺的产率为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com