
【题目】电解法转化CO2可实现CO2资源化利用,现电解CO2制HCOOH的原理示意图如图所示。下列说法不正确的是
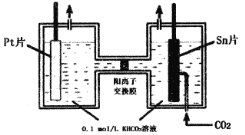
A.Sn片与电源负极相连,用多孔锡电极代替普通Sn片更好
B.右池电极方程式为:H2O+2CO2+2e+=HCOO-+HCO3-
C.左池中H2O发生电解生成O2,从而使该池中KHCO3溶液浓度升高
D.溶液中,K+从左池通过阳离子交换膜移向右池
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作说法正确的是
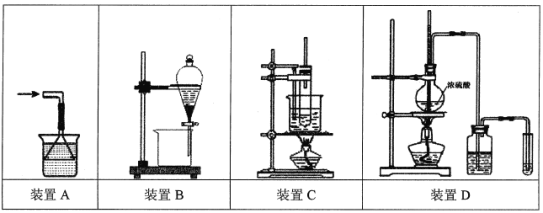
A.处理极易溶于水的气体尾气如NH3时,可选用装置A
B.萃取分离溴水中的Br2,可选用装置B,在萃取剂选择上可使用酒精、苯或CCl4
C.苯的硝化反应实验可选用装置C,反应前在试管中将1.5 mL浓HNO3和2 mL浓硫酸混合均匀,再快速倒入苯,防止其挥发
D.验证乙醇消去反应生成乙烯的实验可选用装置D,洗气瓶内需盛放NaOH溶液,反应开始时,加热烧瓶使混合液迅速上升到170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型二次电池工作原理:2K2S2+KI3![]() K2S4+3KI,装置如图所示。下列说法正确的是( )
K2S4+3KI,装置如图所示。下列说法正确的是( )
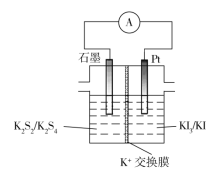
A.放电时,电子由铂极经外电路流向石墨极
B.放电时,负极的电极反应式为2S22--2e=S42-
C.充电时,铂极的电极反应式为I3-+2e-=3I-
D.充电时,若电路中有2mol电子转移,则有2molK由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
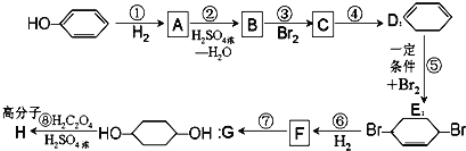
请回答下列问题:
(1)B,F的结构简式为:B__________,F_______________;
(2)反应①~⑦中属于消去反应的是(填代号)_______;
(3)根据反应![]() +Br2
+Br2![]()
![]() ,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__________________;
,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__________________;
(4)写出第④步C→![]() 的化学方程式(有机物写结构简式,注明反应条件)________;
的化学方程式(有机物写结构简式,注明反应条件)________;
(5)与4个不同的原子或原子团相连的碳原子称为手性碳原子;A~G这七种有机物分子中含有手性碳原子的是(填序号)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具![]() 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是![]()
![]()
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5mol
C.每生成1molFe3O4,反应转移的电子为4mol
D.O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com