
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31}
【答案】Al3++3H2O![]() Al(OH)3+3H+ > > NaHA溶液显碱性,说明HA-水解程度大于电离程度 1:6 6
Al(OH)3+3H+ > > NaHA溶液显碱性,说明HA-水解程度大于电离程度 1:6 6
【解析】
(1)硫酸铝溶液中含有铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(2)酸或碱能抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+),故答案为:>;
(3)①溶液显碱性,说明水解大于电离,所以水解出的H2A浓度大于电离出的A2-浓度。②NaHA溶液显碱性,说明HA-水解程度大于电离程度;
(4)①依据氧化还原反应离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可以求得Cr2O72-与FeSO4的物质的量之比为1:6;
②Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=c3(OH-)×6.0×10-7=6.0×10-31 ,c(OH-)=1.0×10-8 ,其pH=6。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。FeSO47H2O广泛用于医药和工业领域,以下是测定某补血剂(有效成分为FeSO47H2O)中铁元素含量的流程图。根据题意完成下列填空:

(1)人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。补血剂与维生素C一起服用,有利于+2价铁的吸收。由此可推知,维生素C具有____________(填“氧化性”或“还原性”)。
(2)步骤Ⅱ需要100mL1mol·L-1的稀硫酸,实验室用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,需用量筒量取浓硫酸____________mL。
(3)步骤Ⅲ所得滤液中滴加KSCN溶液后滤液变为红色,则滤液中含有____________(填离子符号)。检验滤液中还存在Fe2+,应选用的试剂为____________(填字母)
A.NaCl溶液B.酸性KMnO4溶液C.NaOH溶液
(4)步骤Ⅳ加入过量H2O2的目的是____________(用离子方程式表示)。
(5)步骤Ⅵ的一系列操作依次是:①过滤②洗涤③____________④冷却⑤称量⑥恒重操作,操作⑥的目的是____________。
(6)假设实验无损耗,则每片补血剂含铁元素的质量为____________g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见气体在标准状况下的密度为1.25 g·L-1。
(1)该气体的相对分子质量为________。
(2)若该气体的分子式为A2型,其名称为________;
若该气体的分子式为AB型,其名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸能与钠、镁等活泼金属发生置换反应生成H2
D. 1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是________ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时发生的离子反应方程式___________,KMnO4溶液应装在______________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①盐酸与足量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
③对反应3H2(g)+N2(g)![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
④对于反应3KSCN(aq)+ FeCl3(aq)![]() Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①②④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
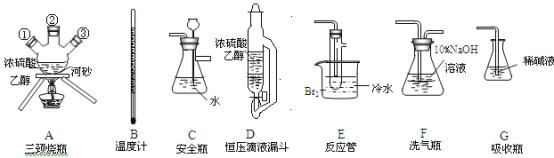
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. 水的电离程度始终增大
D. c(CH3COOH)与c(CH3COO-)之和始终保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com