
【题目】常见气体在标准状况下的密度为1.25 g·L-1。
(1)该气体的相对分子质量为________。
(2)若该气体的分子式为A2型,其名称为________;
若该气体的分子式为AB型,其名称为________。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为__________。
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_____。
③已知CN-与N2互为等电子体,推算HCN分子中σ键与π键数目之比为_____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为________,该单质晶体中原子的堆积方式为四种基本堆积方式中的________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
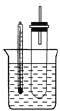
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并指出反应类型。
(1)溴苯的制备_________________________________________________(_____________)。
(2)用甲苯制备TNT _____________________________________________(_____________)。
(3)由丙烯制备聚丙烯____________________________________________(_____________)。
(4)溴乙烷与氢氧化钠的乙醇溶液加热______________________________(_____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
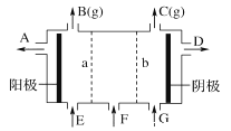
A. 阴极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是NaOH溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某一密闭且体积不变的容器内有可逆反应A(g)+3B(g)![]() 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
A.C物质的生成速率和分解速率相等
B.容器内气体的密度不再随时间而改变
C.单位时间内生成amol物质A,同时生成3amol物质B
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
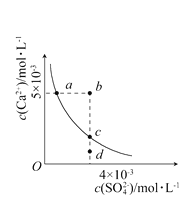
A. 在任何溶液中,c(Ca2+)、c(SO42-)均相等
B. b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol·L-1
C. a点对应的Ksp等于c点对应的Ksp
D. d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是

A. Ag2C2O4+2Cl-![]() 2AgCl+C2O42-的平衡常数为109.04
2AgCl+C2O42-的平衡常数为109.04
B. N点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ksp(Ag2C2O4)的数量级等于10-7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com