
����Ŀ���ζ�ʵ���ǻ�ѧѧ������Ҫ�Ķ���ʵ�顣 ��ش��������⣺
(1)����к͵ζ������ñ�����ζ�δ֪Ũ�ȵ�NaOH��Һ�����в�����ɲⶨ���ƫ�ߵ���________ (��ѡ����ĸ)
A���ζ��յ����ʱ�����ӵζ��̶ܿȣ�����������ȷ��
B��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ
C����ʽ�ζ���������ˮϴ����δ�ñ�������ϴ
D���ζ�ǰ��ʢװ��Һ�ĵζ��ܼ��������ݣ��ζ���������ʧ
(2)������ԭ�ζ�����ȡһ�����IJ�����Һ������ƿ�У���������ϡ���ᣬ��Ũ��Ϊ0.1mol��L��1�ĸ��������Һ�ζ��������м�¼��ʵ�����ݣ�
�ζ����� | ����Һ��� (mL) | ��KMnO4��Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 3.00 | 23.00 |
������ | 25.00 | 4.00 | 24.10 |
�ٵζ�ʱ���������ӷ�Ӧ����ʽ___________��KMnO4��ҺӦװ��______________ (����������������)ʽ�ζ����У��ζ��յ�ʱ�ζ�������_________________________________��
�ڸò�����Һ�����ʵ���Ũ��Ϊ_____________��
(3)�����ζ��D�D�ζ����ͱ��ζ����������ȵζ�����ָʾ��������������ܡ��ο��±��е����ݣ�����AgNO3�ζ�NaSCN��Һ����ѡ�õ�ָʾ����______(��ѡ����ĸ)��
������ | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
��ɫ | �� | dz�� | �� | ש�� | �� |
Ksp | 1.77��10��10 | 5.35��10��13 | 1.21��10��16 | 1.12��10��12 | 1.0��10��12 |
A��NaCl B��NaBr C��NaCN D��Na2CrO4
���𰸡�C,D 5H2C2O4 + 2MnO4- + 6H+= 10CO2�� + 2Mn2+ + 8H2O �� ��ƿ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ 0.2 mol��L-1 D
��������
��1������c�����⣩=![]() ��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��2���ٸ��ݸ��������Һ����ǿ������ѡ��ζ������ͣ����ݵζ�����ǰ��ҺΪ��ɫ���ζ�����ʱ��Һ����Ϻ�ɫΪ�ζ��յ㣻
�����жϵζ����ݵ���Ч�ԣ�Ȼ���������ı�Һ��ƽ��������ٸ���c�����⣩=![]() �������������Һ��Ũ�ȣ�
�������������Һ��Ũ�ȣ�
��3���ζ�����ʱ�������μӵζ������ζ�����ָʾ����Ӧ������������ɫ�仯�ij�������֤�ζ����ͱ��ζ�����ȫ��Ӧ��
��1��A���ζ��յ����ʱ�����ӵζ��̶ܿȣ�����������ȷ���������ĵı�Һ�������ƫС������c�����⣩=![]() ��֪���ⶨ���ƫ�ͣ�ѡ��A����
��֪���ⶨ���ƫ�ͣ�ѡ��A����
B��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ���˲�����ȷ����Ӱ��ⶨ�����ѡ��B����
C����ʽ�ζ���������ˮϴ����δ�ñ�������ϴ�����±�ҺŨ�ȼ�С���ζ�ʱ���ĵı�Һ���������c�����⣩=![]() ��֪���ⶨ���ƫ�ߣ�ѡ��C��ȷ��
��֪���ⶨ���ƫ�ߣ�ѡ��C��ȷ��
D���ζ�ǰ���ζ��ܼ��������ݣ��ζ���������ʧ���������ĵı�Һ���ƫ����c�����⣩=![]() ��֪���ⶨ���ƫ�ߣ�ѡ��D��ȷ��
��֪���ⶨ���ƫ�ߣ�ѡ��D��ȷ��
��ѡ��CD��
��2�����ζ�ʱ���ᱻ���Ը��������Һ���������������ӷ�Ӧ����ʽΪ5H2C2O4 + 2MnO4- + 6H+= 10CO2�� + 2Mn2+ + 8H2O��
���������Һ����ǿ�����ԣ��ܹ�������ʽ�ζ��ܵ��ܣ�����Ӧ��ʹ����ʽ�ζ���ʢװ���������Һ���ζ�����ǰ���ҺΪ��ɫ���ζ�����ʱ���Һ������Ϻ�ɫ�����Եζ��յ�����Ϊ����ƿ����Һ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�����εζ����ı�Һ����ֱ�Ϊ����20.40-0.50��mL=19.90mL����23.00-3.00��mL=20.00 mL����24.10-4.00��mL=20.10mL���ɼ����εζ������ݶ�����Ч�ģ����ı�Һ��ƽ�����Ϊ��![]() =20.00mL��������ص����ʵ���Ϊ��0.1molL-1��0.020L=0.0020mol�����ݷ�Ӧ2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��֪��n��H2C2O4��=
=20.00mL��������ص����ʵ���Ϊ��0.1molL-1��0.020L=0.0020mol�����ݷ�Ӧ2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��֪��n��H2C2O4��=![]() n��KMnO4��=0.005mol�������Һ��������ʵ���Ũ��Ϊ��
n��KMnO4��=0.005mol�������Һ��������ʵ���Ũ��Ϊ��![]() =0.2 molL-1��
=0.2 molL-1��
��3������AgNO3ȥ�ζ�NaSCN��Һ����ѡ�õĵζ�ָʾ�������ʵ��ܽ��Ӧ��AgSCN�����������ԣ�ӦΪNa2CrO4�����������ש��ɫ�������ɣ��ʴ�Ϊ��D��


 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ��֤Ũ�����ܽ�NO������NO2����ϡ���������NO�������ͼװ�ý���ʵ�飨�г���������ȥ�������������ϣ���NO��NaOH��Һ����Ӧ��NO2��NaOH��Һ�ܷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ2NO2+2NaOHNaNO3+NaNO2+H2O����
��ѡҩƷ��Ũ���ᡢ3mol��L-1ϡ���ᡢ����ˮ��Ũ���ᡢNaOH��Һ��CO2���塣�ش��������⡣

��1�����Ӻ�װ�ã��μ�Ũ����֮ǰ�IJ��������ǣ�____________������ҩƷ����װ�â��еĵ��ɼк�ͨ��CO2һ��ʱ�䣬�رյ��ɼУ���װ�â��е���ĩ�����뵹�õ���ƿ�ڡ�ͨ��CO2��Ŀ����____________��
��2��������������Ϊ70%Ũ���ᣨ�ܶ�Ϊ1.42g��cm-3������250mL3mol��L-1��ϡ���ᣬ����Ͳ���ձ�����ͷ�ι��⣬��Ҫ�õ��IJ���������____________��____________��
��3��װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ____________��
��4��װ�â��в���������ͨ��ʢ��ˮ��ϴ��ƿʱ������Ӧ�Ļ�ѧ����ʽΪ____________��
��5������ʵ����ƣ�װ�â���ʢ�ŵ��Լ���____________��
��6����ʵ��ʱӦ�����к������ŷŵ������У�װ�â���ʢ�ŵ�ҩƷ��____________��
��7����֤Ũ�����ܽ�NO������NO2����ϡ���������NO��ʵ��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ijһ�ܱ������������������п��淴ӦA��g����3B��g��![]() 2C��g�����÷�Ӧ���е�һ���Ⱥ�ﵽ�˻�ѧƽ�⣬�û�ѧƽ��ı�־�ǣ� ��
2C��g�����÷�Ӧ���е�һ���Ⱥ�ﵽ�˻�ѧƽ�⣬�û�ѧƽ��ı�־�ǣ� ��
A.C���ʵ��������ʺͷֽ��������
B.������������ܶȲ�����ʱ����ı�
C.��λʱ��������amol����A��ͬʱ����3amol����B
D.A��B��C�ķ�����֮��Ϊ1��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊȼ�ϵ�ȼ�ϵ�أ���������Ч�ʸߵ��ص㣬���ⰱ���������ߣ���Һ����������������棬�Ǻܺõ���Դ���塣NH3��O2ȼ�ϵ�صĽṹ��ͼ��ʾ������˵����ȷ����( )
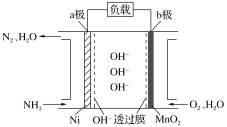
A.a��Ϊ��ص�����
B.�����ĵ缫��ӦʽΪ2NH3��6e����6OH��=N2��6H2O
C.������1 mol N2ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ3 mol
D.���·�ĵ�������Ϊ��a������b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⡣����Ҫ��ش����}��
(1)����������������ˮ�����侻ˮ��ԭ����_____________(�����ӷ���ʽ��ʾ)��
(2)�����£�ȡ0.2 mol/L HCl��Һ��0.2mol/L MOH��Һ�������ϣ���û�Ϻ���Һ��pH=5����PH=13��MOH��Һ��Ũ��_______0.1mol/L(�������)��
(3)0.1mol/L��NaHA��Һ�������Һ�Լ��ԡ���
�� ����Һ�� c(H2A)_______________c(A2-)(�������)��
�� ���������жϵ�������_____________(�����ֽ���)��
(4)��Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3 mol/L��Cr2O72-��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
�̷�ΪFeSO4 7H2O����Ӧ(I)��Cr2O72-��FeSO4�����ʵ���֮��Ϊ___________����������������ķ�ˮ��c(Cr3+)=6.0��10-7mol/L��������ķ�ˮ�� pH=_______��{Ksp[Cr(OH)3]=6.0��10-31}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ij�¶��£�һԪ����HA��KaԽС����NaA��Kh(ˮ��ƽ�ⳣ��)ԽС
B. ���ܶ�п��ֲ�����������Բ�������
C. ͭ�ȿ��Է������ⸯʴ�ֿ��Է���������ʴ
D. �����ú����������C2H5OH��CH3OCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þһ������صĹ���ԭ����ͼ��ʾ����ط�ӦΪMg+O2+2H2O=2Mg(OH)2�������йظõ�ص�˵������ȷ���ǣ���֪�����ӽ���Ĥ��������ֻ����������ͨ������ ��

A.ͨ�������ĵ缫Ϊ����
B.�ŵ�ʱ����Һ�е�OH-����
C.�����ĵ缫��ӦʽΪMg-2e-+2OH-=Mg(OH)2
D.����·��ת��0.04mol����ʱ���μӷ�Ӧ��O2Ϊ0.02mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�pH��11�İ�ˮ��NaOH��Һ�ֱ��ˮϡ��100������Һ��pH����Һ����仯��������ͼ��ʾ������ͼ���жϴ�����ǣ� ��

A. aֵһ������9
B. ��ΪNaOH��Һϡ��ʱ��Һ��pH�仯����
C. ��ȫ�к�ϡ����ͬ�����������Һ��������ͬŨ�ȵ�ϡH2SO4�����V(NaOH)<V(��ˮ)
D. ϡ�ͺ�ˮ��ˮ�ĵ���̶ȱ�NaOH��Һ��ˮ�ĵ���̶ȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com