
【题目】以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。NH3-O2燃料电池的结构如图所示,下列说法正确的是( )
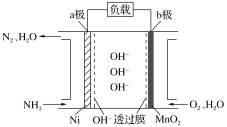
A.a极为电池的正极
B.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
C.当生成1 mol N2时,电路中通过的电子的物质的量为3 mol
D.外电路的电流方向为从a极流向b极
科目:高中化学 来源: 题型:
【题目】(每空1分)Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
(1)下列有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,写出苯与溴发生反应的化学方程式 ___________________________________,
预测该芳香烃____________ (填“能”或“不能”)发生该类反应。
A.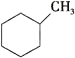 B.
B. C.
C.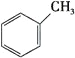
(2)下列有机物属于羧酸类的是_________ (填字母)。
a.CH3CHO b.![]() c.
c. 
(3)下列有机物属于糖类的是_________ (填字母)。
A.油脂 B.纤维素 C.蛋白质
Ⅱ.下列几组物质中,互为同位素的有____________,互为同素异形体的有___________,互为同系物的有____________,互为同分异构体的有____________,属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]() ④
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________。
(3)10种元素中最高价氧化物的水化物,酸性最强的是__________。
(4)元素⑦组成的含非极性键的分子的电子式:__________。
(5)区分①、②的碳酸正盐的简单实验方法__________。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为__________。
(7)③的单质与⑥的最高价氧化物反应的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸能与钠、镁等活泼金属发生置换反应生成H2
D. 1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
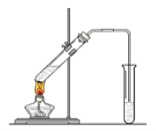
(1)写出制取乙酸乙酯的化学反应方程式:_____________
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:________________。
(3)浓硫酸的作用是:①_________;②________。
(4)饱和碳酸钠溶液的主要作用是________、____ 、______。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是___________。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_________。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是________ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时发生的离子反应方程式___________,KMnO4溶液应装在______________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
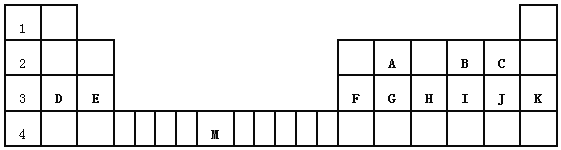
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
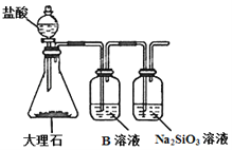
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
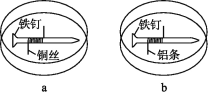
A. a中铁钉发生反应:Fe-3e-=Fe3+
B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应:O2+2H2O+4e-=4OH-
D. b中铝条附近有气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com