
【题目】下列实验操作说法正确的是
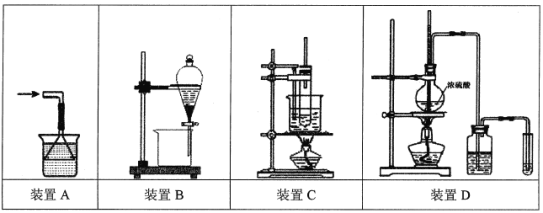
A.处理极易溶于水的气体尾气如NH3时,可选用装置A
B.萃取分离溴水中的Br2,可选用装置B,在萃取剂选择上可使用酒精、苯或CCl4
C.苯的硝化反应实验可选用装置C,反应前在试管中将1.5 mL浓HNO3和2 mL浓硫酸混合均匀,再快速倒入苯,防止其挥发
D.验证乙醇消去反应生成乙烯的实验可选用装置D,洗气瓶内需盛放NaOH溶液,反应开始时,加热烧瓶使混合液迅速上升到170℃
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在生产生活中有着极其重要的作用。现以低品位镍红土矿(主要成分为镍的氧化物、Fe2O3·H2O和SiO2等)为原料制备兰尼镍的工艺流程如图所示:
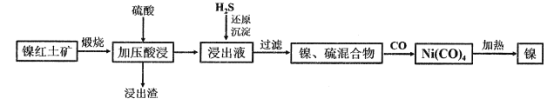
已知加压酸浸过程中的相关影响因素如下:
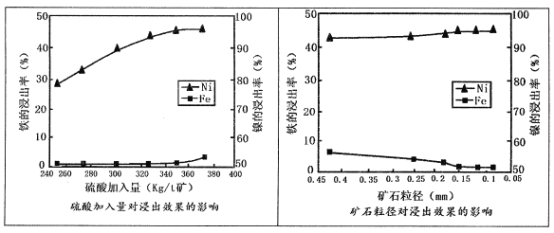
请回答:
(1)请根据图示,选择加压酸浸过程中硫酸的加入量和矿石粒径的最适宜条件为_______
A.260Kg/t矿;0.45mm B.320 Kg/t矿:0.25mm
C.350Kg/t矿;0.15mm D.380 Kg/t矿;0.05mm
(2)①已知镍红土矿煅烧后生成Ni2O3,而加压酸浸后浸出液中含有Ni2+,写出加压酸浸过程中镍元素所涉及的化学反应方程式____________。
②甲同学取该浸出液,控制pH为2~3,经过-系列操作,制取少量NiSO4·7H2O晶体。其控制pH为2~3的目的为____________________________________________________。
③乙同学取该浸出液,经多次处理,得到一定浓度的NiSO4溶液,往其中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,该反应的离子方程式为____________。
(3)向浸出液中通入H2S气体,该反应的离子方程式为__________。
(4)下列说法正确的是________________
A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分
B.加压酸浸中,为加快反应速率,可选用浓硫酸
C.加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O
D.CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将少量溴水加入KI溶液中,再加入CCl4,振荡静置,可观察到下层液体呈紫色,证明Br2的氧化性强于I2
B.SO2能使紫色酸性高锰酸钾溶液褪色,证明SO2具有漂白性
C.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如右图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.充电时,电池的甲电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法转化CO2可实现CO2资源化利用,现电解CO2制HCOOH的原理示意图如图所示。下列说法不正确的是
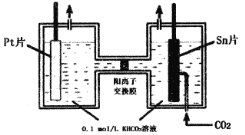
A.Sn片与电源负极相连,用多孔锡电极代替普通Sn片更好
B.右池电极方程式为:H2O+2CO2+2e+=HCOO-+HCO3-
C.左池中H2O发生电解生成O2,从而使该池中KHCO3溶液浓度升高
D.溶液中,K+从左池通过阳离子交换膜移向右池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05 mol/L Ba(OH)2溶液,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法不正确的是
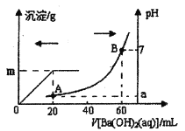
A.原混合液中盐酸物质的量浓度为0.2 mol/L
B.逐滴加入Ba(OH)2溶液,当体积为40 mL,此时发生的离子方程式:OH-+H+=H2O
C.生成沉淀的最大质量m=2.33g
D.现将上述20 mL酸混合溶液与60 mL Ba(OH)2溶液直接混合,发生的离子方程式:Ba2++6OH-+SO42-+6H+=BaSO4↓+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com