
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于_____________;Z4+的核外电子排布式为____________。
(2)X的该种氢化物分子构型为_______,X在该氢化物中以________方式杂化。X和Y形成的化合物的熔点应该________(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是___________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________ m。
【答案】 第4周期第ⅡA族 1s22s22p63s23p6 直线形 sp 高于 TiO2+BaCO3(熔融)===BaTiO3+CO2↑ 面心 6 6.15×10-11
【解析】Z的核电荷数小于28,且次外层有2个未成对电子,其价层电子排布应为3d24s2,所以Z为Ti元素,X的一种1:1型氢化物分子中既有σ键又有π键,应为H-C≡C-H,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数=20,为Ca元素。
(1)Y为Ca元素,原子序数为20,原子核外有4个电子层,最外层电子数为2,则应位于周期表第4周期第ⅡA族,Z为Ti,Z4+的核外电子排布式为1s22s22p63s23p6;
(2)X为C,对应的该氢化物乙炔为直线形分子,C形成2个δ键,为sp杂化,X和Y形成的化合物为CaC2,为离子晶体,熔点高于分子晶体;
(3)①由题意知M为BaTiO3,反应的化学方程式为TiO2+BaCO3=BaTiO3+CO2↑;②在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心;③由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为6;④设Ti4+的半径为r,则有2×1.40×10-10 m + 2r = 4.03×10-10 m,则r=6.15×10-11 m。


科目:高中化学 来源: 题型:
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )

A. 电流表指针不发生偏转
B. Al、Pt两极有H2产生
C. 甲池pH减小,乙池pH不变
D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大发现了人工合成金刚石的新方法,化学原理为:Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
A. 该反应中,钠作还原剂,二氧化碳作氧化剂
B. 每生成1mol Na2CO3时,共转移4mol电子
C. 该反应中Na2CO3是氧化产物
D. 还原性Na大于C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是
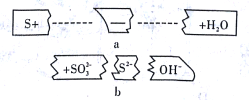
A. 反应物微粒是S、SO32-、OH-
B. 该反应可能在酸性条件下进行
C. 2molS参加反应时,转移的电子数为3NA
D. 氧化剂与还原剂的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________。
(2)根据等电子原理,写出CO分子的结构式______。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是现代社会中必不可少的原料。催化合成氨是氮循环的重要一环。
(1)目前工业上用氢气和氮气合成氨。
①写出工业合成氨的化学方程式_____________________________。
② NH3和PH3的分解温度分别是600℃和500℃,热稳定性差异的原因是
____________________________________________________ ,
元素的非金属性逐渐减弱,氢化物稳定性逐渐减弱。
(2)工业合成氨主要经过原料气(N2、H2)的制取、净化、压缩合成三大过程。
①天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

1mol CH4(g)通过蒸汽转化为CO2(g)和H2(g)的热化学方程式是
______________________________________________________。
②CO变换过程可由Fe2O3催化完成。将下述催化过程补充完整:
i.3Fe2O3 + CO = 2Fe3O4 + CO2
ii._____________________________________________
③醋酸铜氨液可以吸收原料气中CO等少量杂质。吸收CO反应为:
[Cu(NH3)2]Ac(aq)+NH3(aq)+CO(g)==[Cu(NH3)3CO]Ac(aq) △H <0。
下图表示压强和温度对醋酸铜氨液吸收CO能力的影响。L(L1、L2),X可分别代表压强或温度。

i.X代表的物理量是_________。
ii.判断L1、L2的大小关系并简述理由_________________________________________。
(3)电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt-C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
①Pt-C3N4电极反应产生的气体是NH3和______。

②实验表明,其它条件不变,逐渐增加电解电压,氨气生成速率会逐渐增大,但当电解电压高于1.2V后,氨气生成速率反而会随电压升高而下降,分析其可能原因_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com