
【题目】下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑ + H2OB.CaO+H2O=Ca(OH)2
C.2H2O2 2H2O+O2↑D.CaCO3
2H2O+O2↑D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中,有广泛应用,它的工作原理如下:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2.下列叙述正确的是
Cd(OH)2+2Ni(OH)2.下列叙述正确的是
A. 该电池放电的时候,负极附近pH增大
B. 放电时每转移2mol电子,有2mol NiO(OH)被氧化
C. 充电时,阳极反应式是Ni(OH)2-e-+OH-=NiO(OH)+H2O
D. 充电时,Cd电极接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molFeCl3完全水解生成的Fe(OH)3胶粒数为0.1NA
B.0.1mol/LNa2SO3溶液中离子总数大于0.3NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.1NA
D.将0.1molO2与0.2molNO在密闭容器中允分反应,反应后容器内分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制![]() 溶液时为防止其水解,可加入少量________。用离子方程式表示
溶液时为防止其水解,可加入少量________。用离子方程式表示![]() 可作净水剂的原因__________________________________。
可作净水剂的原因__________________________________。
(2)常温下,pH均为11的氢氧化钠溶液和硫化钠溶液中,水电离出的![]() 浓度之比为________。向硫化钠溶液中加入氯化铝时,产生白色沉淀和臭鸡蛋气味的气体,反应的离子方程式为_______________________________________________。
浓度之比为________。向硫化钠溶液中加入氯化铝时,产生白色沉淀和臭鸡蛋气味的气体,反应的离子方程式为_______________________________________________。
(3)在![]() 时,有pH为a的盐酸和pH为b的NaOH溶液,取
时,有pH为a的盐酸和pH为b的NaOH溶液,取![]() 该盐酸,同该NaOH溶液恰好中和,需
该盐酸,同该NaOH溶液恰好中和,需![]() 溶液。若
溶液。若![]() ,则
,则![]() _________。
_________。
(4)用石墨作电极,在![]() 、
、![]() 、
、![]() 、
、![]() 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
①当阴极放出![]() ,阳极放出
,阳极放出![]() 时,电解质是________。
时,电解质是________。
②当阴极析出金属,阳极放出![]() 时,电解质是________。
时,电解质是________。
③当阴极放出![]() ,阳极放出
,阳极放出![]() 时,电解质是________。
时,电解质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
A. 右图表示反应①中的能量变化

B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1 mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3)。下列说法正确的是

A. 简单阴离子的还原性:Z<W
B. X、Y分别与W形成的化合物皆为离子化合物
C. 乙固体中加入甲的溶液或浓氨水,固体都能溶解
D. Y、Z的简单离子都会影响水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种
B.结构简式为![]() 的烃,分子中含有两个苯环的该烃的同分异构体为2种
的烃,分子中含有两个苯环的该烃的同分异构体为2种
C.含有5个碳原子的饱和链烃,其一氯取代物有8种
D.菲的结构简式为 ,它与硝酸反应,可生成3种一硝基取代物
,它与硝酸反应,可生成3种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以 H3AsO3 形式存在)含量极高,为控制砷的排放, 某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多 2 个电子层,砷在元素周期表的位置为_____。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反 应的离子方程式为_____。
(2)电镀厂的废水中含有的 CN-有剧毒,需要处理加以排放。处理含 CN-废水的方法之一是在 微生物的作用下,CN-被氧气氧化成 HCO3- ,同时生成 NH3,该反应的离子方程式为_____。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子, A―表示乳酸根离子):
①阳极的电极反应式为_____
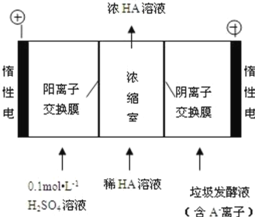
②电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的 OH-可忽略不 计。400 mL 10 g·L-1 乳酸溶液通电一段时间后, 浓度上升为 145 g/L(溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____L (已知:乳酸的摩尔质量为 90 g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com