
【题目】食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是( )
A.用甲醛浸泡海鲜B.用硫磺薰制白木耳
C.用小苏打做发酵粉D.用工业酒精兑制白酒
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是

A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。
B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。
C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。
D. 元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经一定时间后,可逆反应aA+bBcC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( ) 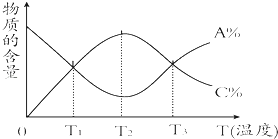
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取高纯MnO2的流程如下:

(1)酸浸时所发生主要反应的离子方程式为_____________。
(2)酸浸时加入一定体积的硫酸,硫酸浓度不能过小或过大。当硫酸浓度偏小时,酸浸时会有红褐色渣出现,原因是_______。硫酸浓度不能过大的原因是_____________。
(3)过滤Ⅱ所得滤渣为MnCO3,滤液中溶质的主要成分是_____。
(4)焙烧MnCO3的装置如下图所示:

①焙烧时所发生反应的化学方程式为__________。
②焙烧一定时间后需转动石英管,目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨气的说法正确的是( )
A.氨气既能用浓硫酸干燥也能用无水CaCl2干燥
B.NH3是电解质,所以氨水能导电
C.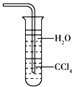
用水吸收NH3用如图装置可防止倒吸
D.NH3可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com