
【题目】下列关于氨气的说法正确的是( )
A.氨气既能用浓硫酸干燥也能用无水CaCl2干燥
B.NH3是电解质,所以氨水能导电
C.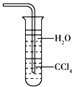
用水吸收NH3用如图装置可防止倒吸
D.NH3可以使干燥的红色石蕊试纸变蓝
【答案】C
【解析】解:A.浓硫酸具有酸性与氨气反应生成铵盐,所以不能用浓硫酸干燥氨气,氨气和氯化钙结合生成络合物,不能用无水CaCl2干燥,故A错误;
B.氨气本身不能电离出自由移动的离子,不属于电解质,故B错误;
C.氨气不溶于四氯化碳,用该装置吸收氨气,氨气与水不能直接接触,可以防止倒吸,故C正确;
D.石蕊试剂遇碱变蓝色,氨气为非电解质,不能电离产生氢氧根离子,氨气和水反应生成一水合氨电离出离子溶液导电,故D错误;
故选C.
【考点精析】本题主要考查了氨的化学性质的相关知识点,需要掌握与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;


科目:高中化学 来源: 题型:
【题目】食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是( )
A.用甲醛浸泡海鲜B.用硫磺薰制白木耳
C.用小苏打做发酵粉D.用工业酒精兑制白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A.10 g H2和10 g O2
B.5.6 L N2和5.6 L CO2
C.14 g CO和0.5 mol Br2
D.标准状况下2.24 L H2O和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
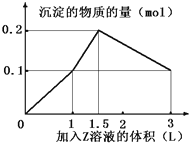
A. 偏铝酸钠、氯化钡、硫酸 B. 偏铝酸钠、氢氧化钡、硫酸
C. 氯化铝、氯化铁、氢氧化钠 D. 氯化铝、氯化镁、氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下:
(1)固体B的主要用途有(写出1条即可) .
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:;
(3)第③步中,生成氢氧化铝的离子方程式是 .
若往A溶液中通入足量CO2 , 请写出可能发生反应的离子方程式 .
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是 .
(5)将实验过程中所得固体精确称量.课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数.(写出计算过程,计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤,在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第④步电解时阴极产生氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铅[化学式为2PbCO3·Pb(OH)2]是生产铅酸蓄电池正极的原料。
(1) 某研究小组制备碱式碳酸铅的主要实验流程如下:

①“反应①”的生成物是(CH3COO)2Pb·Pb(OH)2,该反应是在90℃、搅拌并保温3 h的条件下完成的,则该反应的化学方程式为_______________________________________。
②过滤时所需要的玻璃仪器有漏斗、________。
③沉淀经水洗涤后又用酒精洗涤的目的是____________________________________。
(2) 为确定2PbCO3·Pb(OH)2的热分解过程,进行了如下实验:
称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如下图所示。

①A→B过程中,逸出的分解产物的化学式为______________;E点残留固体的化学式为______________。
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s) +6C(s)+2N2(g) ![]() Si3N4(s) +____CO(g)
Si3N4(s) +____CO(g)
(1)在横线上填上化学计量数;
(2)该反应的氧化剂是________,
(3)该反应的平衡常数表达式为K=__________;
(4)若知上述反应为放热反应,则其反应热△H_____0(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向______反应方向移动(填“正”或“逆”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com