
����Ŀ��ij����С���о���������Al2O3�ĺ������������ϵ�֪�����������Ҫ�ɷ���Al2O3 �� ������Fe2O3��SiO2�ȣ�������������ȡAl2O3�Ĺ������£�
��1������B����Ҫ��;�У�д��1�����ɣ� ��
��2���ڢٲ������������м��������ռ���Һ����ַ�Ӧ��������Ӧ�����ӷ���ʽ�ǣ���
��3���ڢ۲��У������������������ӷ���ʽ�� ��
����A��Һ��ͨ������CO2 �� ��д�����ܷ�����Ӧ�����ӷ���ʽ ��
��4����ҵ����ȡAlCl3��Al2O3��C��Cl2�ڸ��������·�Ӧ��ÿ����0.5mol̼���ʣ�ת��1mol���ӣ���Ӧ�Ļ�ѧ����ʽ�� ��
��5����ʵ����������ù��徫ȷ����������С�鷢�������������������������ԭ������������ȣ������������Al2O3��������������д��������̣�����������һλС����
���𰸡�
��1������ԭ�ϡ�����Ϳ�ϡ������
��2��Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O
��3��Al3++3NH3?H2O=Al��OH��3��+3NH4+��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3����SiO32��+2CO2+2H2O�TH2SiO3��+2HCO3��
��4��Al2O3+3Cl2+3C ![]() 2AlCl3+3CO
2AlCl3+3CO
��5��
��ʵ����������ù��徫ȷ����������С�鷢�������������������������ԭ������������ȣ�˵�������������������������ԭ������������ȣ�����������Al2O3������������������������������������������ͬ�ģ�����Ϊ����������д��Al2O33H2O����ʽ���������������� ![]() ��100%=65.4%��
��100%=65.4%��
����������Al2O3����������Ϊ65.4%��
���������⣺��1�����������м��������ռ���Һ�����ڢٵõ���Һ�к���ƫ��������ӡ���������ӣ�����Ϊ������������������Ϊ������ԭ�ϣ�������Ϊ��ɫ��������Ϳ�ϡ�����ȣ��ʴ�Ϊ������ԭ�ϡ�����Ϳ�ϡ�����ȣ�
��2�����ݿ�ͼ���̣����������м��������ռ���Һ�����������������������Һǿ��������ǿ�ֻFe2O3����ǿ�ᣬ�����ڼSiO2ֻ����ǿ��������ᣬ���ڢٵõ���Һ�к���ƫ��������ӡ���������ӣ�����Ϊ������������������������Һ����Ӧ�������������м��������ռ���Һ������Ӧ�����ӷ���ʽ��Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O���ʴ�Ϊ��Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O��
��3���Լ���Ϊ��ˮ����������ת��Ϊ�����������������ӷ���ʽΪ��Al3++3NH3H2O=Al��OH��3��+3NH4+������A��Һ��ͨ������CO2 �� ��������Ӻ�ƫ��������ӷ�Ӧ���ɹ����������������Ӧ�����ӷ���ʽΪ��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3����SiO32��+2CO2+2H2O�TH2SiO3��+2HCO3�����ʴ�Ϊ��Al3++3NH3H2O=Al��OH��3��+3NH4+��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3����SiO32��+2CO2+2H2O�TH2SiO3��+2HCO3����
��4��Cl2��ǿ�����ԣ�̼���л�ԭ�ԣ�ÿ����0.5 mol ̼���ʣ�ת��1mol���ӣ���˵����Ӧ��̼ʧȥ2�����ӣ�������������CO�����Է�Ӧ�Ļ�ѧ����ʽ��Al2O3+3Cl2+3C ![]() 2AlCl3+3CO���ʴ�Ϊ��Al2O3+3Cl2+3C
2AlCl3+3CO���ʴ�Ϊ��Al2O3+3Cl2+3C ![]() 2AlCl3+3CO��
2AlCl3+3CO��
��5����ʵ����������ù��徫ȷ����������С�鷢�������������������������ԭ������������ȣ�˵�������������������������ԭ������������ȣ�����������Al2O3������������������������������������������ͬ�ģ�����Ϊ����������д��Al2O33H2O����ʽ���������������� ![]() ��100%=65.4%������������Al2O3����������Ϊ65.4%��
��100%=65.4%������������Al2O3����������Ϊ65.4%��
���������м��������ռ���Һ�����������������������Һǿ��������ǿ�ֻFe2O3����ǿ�ᣬ�����ڼSiO2ֻ����ǿ��������ᣬ���ڢٵõ���Һ�к���ƫ��������ӡ���������ӣ������������ɹ�����Ȼ������Ȼ�����Һ�е��백ˮ�������������������������ȷֽ⣬�������������ɴ˷�����𣮣�1��������Ϊ��ɫ��������죬������Ϳ�ϡ�����ȣ���2�����������м��������ռ���Һ�����������������������Һǿ��������ǿ�ֻFe2O3����ǿ�ᣬ�����ڼSiO2ֻ����ǿ��������ᣬ���ڢٵõ���Һ�к���ƫ��������ӡ���������ӣ���3���Լ���Ϊ��ˮ����������ת��Ϊ�����������������ȷֽ��������������A��Һ��ͨ������CO2 �� ��������Ӻ�ƫ��������ӷ�Ӧ���ɹ����������������4��Cl2��ǿ�����ԣ���C����ΪCO����������ԭΪC1�� �� ���ݵ�ʧ�����غ��𣻣�5�������������������������ԭ������������ȣ���˵����������Al2O3������������������������������������������ͬ��������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ����ȤС�����������ַ�����ȡ������

��֪:����̿����������ˮ�е���״������
��1������һ��������Ӧ�Ļ�ѧ����ʽΪ_________________��
��2�����鷽��һ��Ӧ��������Һ���Ƿ���NH4+��ʵ�鷽����_________________��
��3������������ˮ��ȴ��U ��������������_________________���ñ�ˮ��ȴ��Ŀ����_________________��
��4������һ�뷽������������е��ŵ���_________________��
��5������һ�ͷ������о����õ�NH4Cl��NH4Cl���ܽ�����¶ȱ仯����������ͼ��ʾ,��ҵNH4Cl�����к���������FeCl2����ͨ������ʵ�����ᴿ:����ҵNH4Cl��������ˮ��_________,������Һ��pHΪ4~5������Һ�м������̿������Һ����Ũ����________��ô�����NH4Cl���塣��ʵ���пɹ�ѡ����Լ���:˫��ˮ��KMnO4��Һ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ���е�����仯һ������ѧ��Ӧ���з����ԡ������й���������ȷ����
A.ԭ��ط�Ӧһ�����Է����е�������ԭ��Ӧ������H��0
B.��H<0����S<0�ķ�Ӧ�϶����Է�����
C.��ϵ��������ͻ��Ҷ������д�ʹ��Ӧ�Է����е�����
D.CaCO3(s) ��CaO(s)+CO2(g)����H��0����S��0���÷�Ӧ�ڽϸ��¶������Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ����( )
A. 7.1g����������NaOH��Һ��Ӧת�Ƶĵ�����Ϊ0.2NA
B. 1mol C10H22�����й��ۼ�����Ϊ32NA
C. �ϳɰ���Ӧ�ﵽƽ��ʱ����1NA N��N�γɵ�ͬʱ������6NA N-H���γ�
D. 1LŨ��Ϊ1mol/L��̼������Һ�к���3NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ�����˵����ȷ���ǣ� ��
A.����������Ũ�������Ҳ������ˮCaCl2����
B.NH3�ǵ���ʣ�����ˮ�ܵ���
C.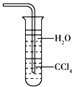
��ˮ����NH3����ͼװ�ÿɷ�ֹ����
D.NH3����ʹ����ĺ�ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����С��Ϊ�˼���Ũ������ľ̿�ڼ��������·�Ӧ������SO2��CO2���壬�������ͼ1��ʾʵ��װ�ã�a��b��cΪֹˮ�У�B�����ڴ��������ң�D�з�����I2�͵��۵���ɫ��Һ��ʪ����֬�ޣ�
��ش���������
��1��������ȼ���ױ����ж��Ļ�ѧ���ʣ������������װ��������Σ�վ����ǩ��ͼ2��Ũ�����Σ�վ����ǩ�� ��
��2��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��ɰܵĹؼ����ڿ��Ʒ�Ӧ������������ʲ��ܹ��죬����������ֵ�װ�ã�����ȷ�IJ���˳�������ò��������д��
����Aװ���м���Ũ���ᣬ���ȣ�ʹA�в����������������B���������г���һ��������ʱ��ֹͣ���ȣ�
�ڴ�װ��A��ȴ��������B��������ٱ仯�ر�ֹˮ��a����ֹˮ��b��������ѹ���ң�ʹ����B��������������װ��C�У����ﵽʵ��Ŀ�ĺر�ֹˮ��b��
�۴�ֹˮ��a��c���ر�ֹˮ��b��
��4��ʵ��ʱ��װ��C�е�����Ϊ��
��5����D�в�������ʱ������˵��ʹE�г���ʯ��ˮ����ǵ���CO2 �� ������SO2��д��D�з�����Ӧ�Ļ�ѧ����ʽ�����������ת�Ʒ������Ŀ ��
��6���� Cu��Ũ���ᷴӦ�ɵ�����ͭ��Һ��ijѧϰС�齫ͭм����һ��Ũ�ȵ������У����Ȳ����Ϲ������Ҳ�ɵ�����ͭ��Һ���䷴Ӧԭ��Ϊ2Cu+O2+2H2SO4�T2CuSO4+2H2O��������12.8gͭ��ȫ�ܽ⣬������ˮ���200mL��Һ�����㣺
�μӷ�Ӧ�������ڱ�״���µ������L��������д������̣�
��7����������ͭ��Һ�����ʵ���Ũ����mol/L������д������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廯��ͭ��������ҵ��������һ�ְ�ɫ��ĩ��������ˮ���������Ҵ����л��ܼ�������ˮ�л���ⶼ��ֽ⣬�ڿ����л�������������ɫ��ĩ���Ʊ�CuBr ��ʵ�鲽�����£�

����1.������ͼ��ʾ��������ƿ�м���45gCuSO4��5H2O�� 19gNaBr��150mL��й�������ˮ��60��ʱ���Ͻ��裬���ʵ�����ͨ��SO2Сʱ��
����2.��Һ��ȴ����ȥ�ϲ���Һ���ڱܹ�������¹��ˡ�
����3.��������������SO2��ˮ����������SO2���Ҵ���������ϴ��
����4.��˫����������ֱ�װ��Ũ����������������и���3��4h���پ������������������ո��
��1��ʵ����������ˮ�辭��У����Ŀ����_______________��
��2������1��
��������ƿ�з�Ӧ����CuBr �����ӷ���ʽΪ___________________��
�ڿ��Ʒ�Ӧ��60�� ���У�ʵ���пɲ�ȡ�Ĵ�ʩ��__________________��
��˵����Ӧ����ɵ�������_____________________��
��3������2 ������Ҫ�ܹ��ԭ����________________________��
��4������3��ϴ�Ӽ���������SO2����ԭ����_____________________��
��5������������װ���ձ��е�����Һ���������Ҫ��Na2SO3��NaHSO3 ������ȡ�ϴ�����Na2SO3��7H2O ���塣�벹��ʵ�鲽��[���õ�SO2�������ڸ�ƿ2����20%NaOH ��Һ]��
��______________________��
��_______________________��
�ۼ�������ά����C ��Һ���������� ������Ũ������ȴ�ᾧ��
�ܹ��ˣ����Ҵ�ϴ��2��3�Ρ��ݷ���ո������и��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϩ�Ʋ��ϩ�Ľṹ����������ȷ���ǣ� ��
A. ����������ԭ�Ӷ���ͬһƽ���� B. ��ϩ�ķе�ȱ�ϩ��
C. ����H2O��HCl�����ӳɷ�Ӧ D. ��ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ˵���ȱ���ķǽ�����ǿ��������ʵ�������ݵ��ǣ�������
A. HCl���ܽ���ǿ��H2S
B. �ȵ����Ϊ+7��
C. H2S�е�S2���ܱ�Cl2����
D. HClO��������ǿ��H2SO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com