
【题目】与自然界中的许多变化一样,化学反应具有方向性。下列有关叙述中正确的是
A.原电池反应一定是自发进行的氧化还原反应,且△H<0
B.ΔH<0,ΔS<0的反应肯定能自发进行
C.体系能量增大和混乱度增大都有促使反应自发进行的倾向
D.CaCO3(s) =CaO(s)+CO2(g)的ΔH>0,ΔS<0,该反应在较高温度下能自发进行
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是:
A. 少量SO2通入NaOH溶液中:OH-+SO2→HSO3-
B. H2S通入氯水中:S2-+Cl2→S↓+2Cl-
C. 二氧化氮溶于水:3NO2+H2O →2H++2NO3-+NO↑
D. 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量是16g
C.6.02×1023个O2分子的质量为32g
D.标准状况下,1mol任何物质的体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的 ![]() )、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆.活塞先左弹,恢复室温后,活塞右滑停留于容器的中央.则原来H2、O2 的物质的量之比可能为:①4:5 ②2:5 ③3:8 ④7:2( )
)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆.活塞先左弹,恢复室温后,活塞右滑停留于容器的中央.则原来H2、O2 的物质的量之比可能为:①4:5 ②2:5 ③3:8 ④7:2( ) 
A.①②
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A.10 g H2和10 g O2
B.5.6 L N2和5.6 L CO2
C.14 g CO和0.5 mol Br2
D.标准状况下2.24 L H2O和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过 ( )。
A.加成反应
B.取代反应
C.聚合反应
D.催化裂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下:
(1)固体B的主要用途有(写出1条即可) .
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:;
(3)第③步中,生成氢氧化铝的离子方程式是 .
若往A溶液中通入足量CO2 , 请写出可能发生反应的离子方程式 .
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是 .
(5)将实验过程中所得固体精确称量.课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数.(写出计算过程,计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
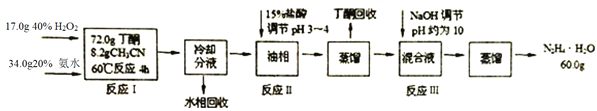
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com