
【题目】溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr 的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、 19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥。最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是_______________。
(2)步骤1中:
①三颈烧瓶中反应生成CuBr 的离子方程式为___________________;
②控制反应在60℃ 进行,实验中可采取的措施是__________________;
③说明反应已完成的现象是_____________________。
(3)步骤2 过滤需要避光的原因是________________________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是_____________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3 等)制取较纯净的Na2SO3·7H2O 晶体。请补充实验步骤[须用到SO2(贮存在钢瓶2)、20%NaOH 溶液]:
①______________________。
②_______________________。
③加入少量维生素C 溶液(抗氧剂) ,蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
【答案】 除去水中溶解的O2 2Cu2++2Br-+SO2+2H2O=2CuBr↓+SO42-+4H+ 60℃水浴加热 溶液蓝色完全褪去 防止CuBr见光分解 防止CuBr被氧化 在烧杯中继续通入SO2至饱和 然后向烧杯中加入100g20%的NaOH 溶液
【解析】本题主要考查对于制取溴化亚铜实验方法的评价。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中溶解的O2,防止溴化亚铜被氧化。
(2)①三颈烧瓶中反应生成CuBr的离子方程式为2Cu2++2Br-+SO2+2H2O=2CuBr↓+SO42-+4H+;
②控制反应在60℃进行,低于100℃可采取水浴加热,实验中可采取的措施是60℃水浴加热;
③说明反应已完成的现象是硫酸铜溶液蓝色完全褪去。
(3)步骤2过滤需要避光的原因是防止CuBr见光分解。
(4)步骤3中洗涤剂需“溶有SO2”的原因是防止CuBr被氧化。
(5)①在烧杯中继续通入SO2至饱和。②然后向烧杯中加入100g20%的NaOH溶液,此时发生反应:SO2+2NaOH![]() Na2SO3+H2O。
Na2SO3+H2O。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量是16g
C.6.02×1023个O2分子的质量为32g
D.标准状况下,1mol任何物质的体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下:
(1)固体B的主要用途有(写出1条即可) .
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:;
(3)第③步中,生成氢氧化铝的离子方程式是 .
若往A溶液中通入足量CO2 , 请写出可能发生反应的离子方程式 .
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是 .
(5)将实验过程中所得固体精确称量.课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数.(写出计算过程,计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤,在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第④步电解时阴极产生氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,并收集纯净干燥的气体.请回答该实验中的问题.
(1)写出该反应的化学方程式;干燥剂是(写名称).
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 .
(3)试管中收集气体是(写化学式),如果要在A处玻璃管处点燃该气体,则必须对该气体进行 . 在虚线框内画出收集该气体的装置图 .(限选仪器:试管、玻璃导管、水槽)
(4)反应后得到黑色固体,主要成分是Fe3O4 , 还含有少量Fe和FeO;限选以下试剂:稀HNO3、稀HCl、KSCN溶液、氯水、CuSO4溶液;
设计实验方案检验所得固体中含有Fe3O4 , 写出实验步骤和实验现象 . 证明固体中含有没完全反应的Fe .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铅[化学式为2PbCO3·Pb(OH)2]是生产铅酸蓄电池正极的原料。
(1) 某研究小组制备碱式碳酸铅的主要实验流程如下:

①“反应①”的生成物是(CH3COO)2Pb·Pb(OH)2,该反应是在90℃、搅拌并保温3 h的条件下完成的,则该反应的化学方程式为_______________________________________。
②过滤时所需要的玻璃仪器有漏斗、________。
③沉淀经水洗涤后又用酒精洗涤的目的是____________________________________。
(2) 为确定2PbCO3·Pb(OH)2的热分解过程,进行了如下实验:
称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如下图所示。

①A→B过程中,逸出的分解产物的化学式为______________;E点残留固体的化学式为______________。
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
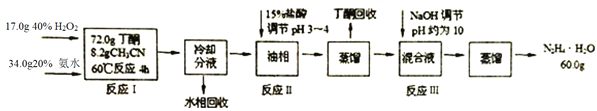
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等.某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2 , 不考虑其它杂质)的含量并制备了绿矾,流程如下: 
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2﹣、SiO32﹣和 .
(2)试剂C是 .
(3)③中反应的离子方程式是 .
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com