
،¾جâؤ؟،؟آج·¯£¨FeSO47H2O£©؟ةسأ×ِ¾»ث®¼ء،¢³²ف¼ءµب£®ؤ³رذ¾؟ذ،×é²â¶¨ءثءٍثل؟َ±؛ةص؛َµؤةصشüضذض÷زھ³ة·ض£¨Fe2O3،¢Al2O3؛حSiO2 £¬ ²»؟¼آائنثüشسضت£©µؤ؛¬ء؟²¢ضئ±¸ءثآج·¯£¬ء÷³جبçدآ£؛ 
اë»ط´ًدآءذختجâ£؛
£¨1£©بـز؛Aضذ؛¬سذµؤزُہë×سض÷زھسذAlO2©پ،¢SiO32©پ؛ح £®
£¨2£©تش¼ءCتا £®
£¨3£©¢غضذ·´س¦µؤہë×س·½³جت½تا £®
£¨4£©ةصشüضذFe2O3،¢Al2O3؛حSiO2µؤخïضتµؤء؟ض®±بتا £®
،¾´ً°¸،؟
£¨1£©OH©پ
£¨2£©د،ءٍثل
£¨3£©Fe+2Fe3+=3Fe2+ £¬ Fe+2H+=Fe2++H2،ü
£¨4£©5£؛5£؛1
،¾½âخِ،؟½â£؛£¨1£©ح¨¹زشةد·ضخِضھ£¬بـز؛Aضذ؛¬سذµؤزُہë×سض÷زھسذAlO2©پ،¢SiO32©پ؛حOH©پ £¬ ثùزش´ً°¸تا£؛OH©پ£»£¨2£©ح¨¹زشةد·ضخِضھ£¬تش¼ءCتاد،ءٍثل£¬ثùزش´ً°¸تا£؛د،ءٍثل£»£¨3£©ح¨¹زشةد·ضخِضھ£¬¢غضذ·´س¦µؤہë×س·½³جت½تاFe+2Fe3+=3Fe2+،¢Fe+2H+=Fe2++H2،ü£¬ثùزش´ً°¸تا£؛Fe+2Fe3+=3Fe2+،¢Fe+2H+=Fe2++H2،ü£»£¨4£©ح¨¹زشةد·ضخِضھ£¬SiO2خھ0.6g£¬Fe2O3خھ8.0g£¬ثùزشAl2O3خھ13.7©پ8.0©پ0.6=5.1g£¬شٍةصشüضذFe2O3،¢Al2O3؛حSiO2µؤخïضتµؤء؟ض®±بتا ![]() £؛
£؛ ![]() £؛
£؛ ![]() =5£؛5£؛1£¬ثùزش´ً°¸تا£؛5£؛5£؛1£®
=5£؛5£؛1£¬ثùزش´ً°¸تا£؛5£؛5£؛1£®



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟نه»¯راح؟ةسأ×÷¹¤زµ´ك»¯¼ء£¬تاز»ضض°×ة«·غؤ©£¬خ¢بـسعہنث®£¬²»بـسعزز´¼µبسذ»ْبـ¼ء£¬شعببث®ضذ»ٍ¼û¹â¶¼»ل·ض½â£¬شع؟صئّضذ»لآآرُ»¯³ةآجة«·غؤ©،£ضئ±¸CuBr µؤتµرé²½ضèبçدآ£؛

²½ضè1.شعبçةدح¼ثùت¾µؤب¾±ةصئ؟ضذ¼سبë45gCuSO4،¤5H2O،¢ 19gNaBr،¢150mLضَ·ذ¹µؤصôءَث®£¬60،وت±²»¶د½ء°è£¬زشتتµ±ء÷ثظح¨بëSO2ذ،ت±،£
²½ضè2.بـز؛ہنب´؛َامب¥ةد²ماهز؛£¬شع±ـ¹âµؤجُ¼دآ¹آث،£
²½ضè3.زہ´خسأبـسذةظء؟SO2µؤث®،¢بـسذةظء؟SO2µؤزز´¼،¢´؟ززأرد´µس
²½ضè4.شعث«²م¸ةشïئ÷£¨·ض±ً×°سذإ¨ءٍثل؛حاâرُ»¯ؤئ£©ضذ¸ةشï3،«4h£¬شظ¾اâئّء÷¸ةشï،£×î؛َ½ّذذصو؟ص¸ةشï،£
£¨1£©تµرéثùسأصôءَث®ذè¾ضَ·ذ£¬ضَ·ذؤ؟µؤتا_______________،£
£¨2£©²½ضè1ضذ£؛
¢ظب¾±ةصئ؟ضذ·´س¦ةْ³ةCuBr µؤہë×س·½³جت½خھ___________________£»
¢ع؟طضئ·´س¦شع60،و ½ّذذ£¬تµرéضذ؟ة²ةب،µؤ´ëت©تا__________________£»
¢غثµأ÷·´س¦زرحê³ةµؤدضدَتا_____________________،£
£¨3£©²½ضè2 ¹آثذèزھ±ـ¹âµؤشزٍتا________________________،£
£¨4£©²½ضè3ضذد´µس¼ءذè،°بـسذSO2،±µؤشزٍتا_____________________،£
£¨5£©سûہûسأةدتِ×°ضأةص±ضذµؤخüتصز؛£¨¾¼ى²âض÷زھ؛¬Na2SO3،¢NaHSO3 µب£©ضئب،½د´؟¾»µؤNa2SO3،¤7H2O ¾§جه،£اë²¹³نتµرé²½ضè[ذëسأµ½SO2£¨ضü´وشع¸ضئ؟2£©،¢20%NaOH بـز؛]£؛
¢ظ______________________،£
¢ع_______________________،£
¢غ¼سبëةظء؟خ¬ةْثطC بـز؛£¨؟¹رُ¼ء£© £¬صô·¢إ¨ثُ£¬ہنب´½ل¾§،£
¢ـ¹آث£¬سأزز´¼د´µس2،«3´خ،£¢ف·إصو؟ص¸ةشïدنضذ¸ةشï،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟زرضھدآءذبب»¯ر§·½³جت½£؛Zn(s)+![]() O2(g)£½ZnO(s) ،،،،،÷H£±£½¨C351.1 kJ/mol
O2(g)£½ZnO(s) ،،،،،÷H£±£½¨C351.1 kJ/mol
Hg(l)+![]() O2(g)£½HgO(s) ،،،،،÷H£²£½¨C90.7 kJ/mol
O2(g)£½HgO(s) ،،،،،÷H£²£½¨C90.7 kJ/mol
سة´ث؟ةضھ·´س¦Zn(s) + HgO(s) £½ ZnO(s) + Hg(l) ،÷H3 £»ئنضذ،÷H3µؤضµخھ ( )
A. ¨C441.8 kJ/mol B. ¨C254.6 kJ/mol
C. ¨C438.9 kJ/mol D. ¨C260.4 kJ/mol
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟خھثµأ÷آب±بءٍµؤ·ا½ًتôذشا؟£¬دآءذتآتµ؟ة×÷زہ¾فµؤتا£¨،،،،£©
A. HClµؤبـ½âذشا؟سعH2S
B. آبµؤ×î¸ك¼غخھ+7¼غ
C. H2SضذµؤS2©پؤـ±»Cl2رُ»¯
D. HClOµؤرُ»¯ذشا؟سعH2SO4
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟بçح¼1ثùت¾µؤ¹³جتاؤ؟ا°ض±½سہûسأج«رôؤـµؤرذ¾؟ببµم£¬بثأا°رح¨¹بث¹¤¹â»¯ر§تض¶خ؛د³ةب¼ءدµؤ¹³ج½ذ×ِبث¹¤¹â؛د×÷سأ£® 
£¨1£©شعبçح¼¹¹دëµؤخïضت؛حؤـء؟ر»·ضذج«رôؤـ×îضص×ھ»¯خھؤـ£®
£¨2£©ح¼2ضذؤـ±يت¾¼×حéب¼ةص¹³جضذµؤؤـء؟±ن»¯µؤتا£¨جîذٍ؛إ£©£®
£¨3£©بث¹¤¹â؛د×÷سأµؤح¾¾¶ض®ز»¾حتاشع´ك»¯¼ء؛ح¹âصصجُ¼دآ£¬½«CO2؛حH2O×ھ»¯خھCH4 £® ¸أ·´س¦µؤ»¯ر§·½³جت½تا £®
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟·´س¦X£¨g£©+Y£¨g£©2Z£¨g£©£»،÷H£¼0£¬´ïµ½ئ½؛âت±£¬دآءذثµ·¨صب·µؤتا
A. ¼ُذ،بفئ÷جه»£¬ئ½؛âدٍسززئ¶¯
B. ¼سبë´ك»¯¼ء£¬Zµؤ²ْآتشِ´َ
C. شِ´َc£¨X£©£¬Xµؤ×ھ»¯آتشِ´َ
D. ½µµحخآ¶ب£¬Yµؤ×ھ»¯آتشِ´َ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟زرضھNaHC2O4بـز؛µؤpH < 7،£³£خآدآ£¬دٍpH=8.4µؤNa2C2O4بـز؛ضذµخ¼س0.1mol/LµؤHClبـز؛£¬بـز؛pHسëpOH[pOH=-lgc(OH-)£فµؤ±ن»¯¹طدµبçح¼ثùت¾£¬دآءذ¸÷µمثùت¾بـز؛ضذخ¢ء£µؤخïضتµؤء؟إ¨¶ب¹طدµز»¶¨صب·µؤتا
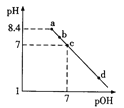
A. aµم£؛c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. bµم£؛c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. cµم£؛c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. dµم£؛c(OH-)+ c(Cl-)=c(H+)+2c(H2C2O4)
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟شع25 ،وت±£¬دآءذ¸÷ضضاé؟ِدآز»¶¨ؤـ´َء؟¹²´وµؤہë×س×éخھ(،،،،)
A. pH£½2µؤبـز؛ضذ£؛Fe2£«،¢Cl£،¢Na£«،¢NO![]()
B. سةث®µçہë³ِµؤc(H£«)£½1،ء10£13mol/Lµؤبـز؛ضذ£؛Na£«،¢CO![]() ،¢Cl£،¢K£«
،¢Cl£،¢K£«
C. شعؤـت¹ت¯بïتشز؛±ن؛ىµؤبـز؛ضذ£؛NH![]() ،¢Cl£،¢Mg2£«،¢SO
،¢Cl£،¢Mg2£«،¢SO![]()
D. شعؤ³خقة«بـز؛ضذ£؛Fe3£«،¢HCO![]() ،¢SO42£،¢Na£«
،¢SO42£،¢Na£«
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟زرضھ²ً؟ھ1mol H©پH¼ü£¬1molN©پH¼ü£¬1molN،شN¼ü·ض±ًذèزھµؤؤـء؟تاakJ،¢bkJ،¢ckJ£¬شٍN2سëH2·´س¦ةْ³ةNH3µؤبب»¯ر§·½³جت½خھ £®
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com