
【题目】已知下列热化学方程式:Zn(s)+![]() O2(g)=ZnO(s) △H1=–351.1 kJ/mol
O2(g)=ZnO(s) △H1=–351.1 kJ/mol
Hg(l)+![]() O2(g)=HgO(s) △H2=–90.7 kJ/mol
O2(g)=HgO(s) △H2=–90.7 kJ/mol
由此可知反应Zn(s) + HgO(s) = ZnO(s) + Hg(l) △H3 ;其中△H3的值为 ( )
A. –441.8 kJ/mol B. –254.6 kJ/mol
C. –438.9 kJ/mol D. –260.4 kJ/mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铅[化学式为2PbCO3·Pb(OH)2]是生产铅酸蓄电池正极的原料。
(1) 某研究小组制备碱式碳酸铅的主要实验流程如下:

①“反应①”的生成物是(CH3COO)2Pb·Pb(OH)2,该反应是在90℃、搅拌并保温3 h的条件下完成的,则该反应的化学方程式为_______________________________________。
②过滤时所需要的玻璃仪器有漏斗、________。
③沉淀经水洗涤后又用酒精洗涤的目的是____________________________________。
(2) 为确定2PbCO3·Pb(OH)2的热分解过程,进行了如下实验:
称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如下图所示。

①A→B过程中,逸出的分解产物的化学式为______________;E点残留固体的化学式为______________。
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
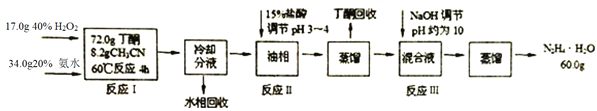
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
B.Cu与稀硝酸的反应 3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
C.CaCO3与盐酸反应 CO32﹣+2H+═CO2↑+H2O
D.实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl﹣═Mn2++Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s) +6C(s)+2N2(g) ![]() Si3N4(s) +____CO(g)
Si3N4(s) +____CO(g)
(1)在横线上填上化学计量数;
(2)该反应的氧化剂是________,
(3)该反应的平衡常数表达式为K=__________;
(4)若知上述反应为放热反应,则其反应热△H_____0(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向______反应方向移动(填“正”或“逆”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等.某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2 , 不考虑其它杂质)的含量并制备了绿矾,流程如下: 
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2﹣、SiO32﹣和 .
(2)试剂C是 .
(3)③中反应的离子方程式是 .
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国淡水资源非常短缺,所以在生产和生活中应该( )
A.减少饮水量,以节约用水
B.将生活用水、工厂废水直接排放到湖泊或海洋中
C.既要防止和消除水体污染,又要节约用水
D.水是取之不尽、用之不竭的天然资源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com