
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s) +6C(s)+2N2(g) ![]() Si3N4(s) +____CO(g)
Si3N4(s) +____CO(g)
(1)在横线上填上化学计量数;
(2)该反应的氧化剂是________,
(3)该反应的平衡常数表达式为K=__________;
(4)若知上述反应为放热反应,则其反应热△H_____0(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向______反应方向移动(填“正”或“逆”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于氨气的说法正确的是( )
A.氨气既能用浓硫酸干燥也能用无水CaCl2干燥
B.NH3是电解质,所以氨水能导电
C.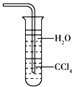
用水吸收NH3用如图装置可防止倒吸
D.NH3可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s)+![]() O2(g)=ZnO(s) △H1=–351.1 kJ/mol
O2(g)=ZnO(s) △H1=–351.1 kJ/mol
Hg(l)+![]() O2(g)=HgO(s) △H2=–90.7 kJ/mol
O2(g)=HgO(s) △H2=–90.7 kJ/mol
由此可知反应Zn(s) + HgO(s) = ZnO(s) + Hg(l) △H3 ;其中△H3的值为 ( )
A. –441.8 kJ/mol B. –254.6 kJ/mol
C. –438.9 kJ/mol D. –260.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)在水溶液中橙红色的Cr2O72--与黄色的CrO42--有下列平衡关系:Cr2O72--+H 2O= 2CrO42--+2H+。现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)、向上述溶液中加入浓硫酸溶液,溶液呈__________色,因为_____________________。
(2)、向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
(II)工业上有一种用CO2生产甲醇燃料的方:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如右图曲线(甲)所示。请完成下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如右图曲线(甲)所示。请完成下列问题:
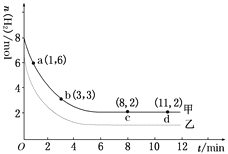
(1)a点正反应速率________逆反应速率(填“>”、“<”或“=”)。
(2)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为说明氯比硫的非金属性强,下列事实可作依据的是( )
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2﹣能被Cl2氧化
D. HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用. 
(1)在如图构想的物质和能量循环中太阳能最终转化为能.
(2)图2中能表示甲烷燃烧过程中的能量变化的是(填序号).
(3)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH4 . 该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是
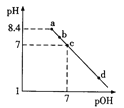
A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)=c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾的化学式可表示为FeSO4·xH2O,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的某些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液颜色无明显变化。充分振荡后,溶液逐渐变红。溶液变红的原因是_________(用离子方程式表示)。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①下列实验操作步骤的正确排序为___________________(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.关闭K1和K2 b.打开K1和K2,缓缓通入N2 c.点燃酒精灯,加热 d.称量A e.冷却到室温 f.熄灭酒精灯
②判断A是否恒重的方法是____________________。
③根据实验记录,绿矾化学式中结晶水数目x=________________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入由下图所示仪器组装而成的装置中,打开K1和K2,缓缓通入N2一段时间后,加热。实验后反应管中残留固体为红色粉末。
①反应中有两种气体产物生成,为检验该气体混合物的组成,请从下图所示的仪器中,选择合适的仪器(含其中的试剂),组成一套实验装置,该装置的连接顺序(按气体流向从左到右)依次为___________→D(填装置序号)。装置中除有气泡冒出外,其他证明实验结论的现象分别为__________________________。

②硫酸亚铁高温分解的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com