
【题目】下面是s能级和p能级的原子轨道图,下列说法正确的是( )
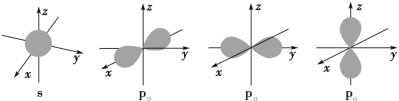
A.s电子的原子轨道呈球形,P轨道电子沿轴呈“8”字形运动
B.s能级电子能量低于p能级
C.每个p能级有3个原子轨道,在空间伸展方向是不同的
D.任一电子层的能级总是从s能级开始,而且能级数等于该电子层序数
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡托普利(E)是一种血管紧张素转化酶抑制剂,被应用于治疗高血压和某些类型的充血性心力衰竭。合成路线如下:
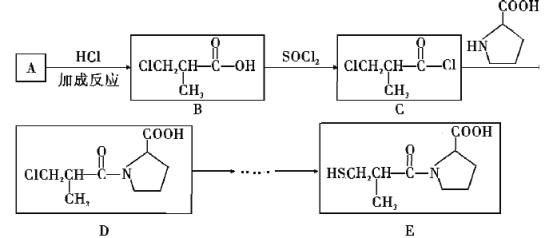
(1) A中官能团的名称是______________,A→B反应方程式为_______________。C→D的反应类型是_________________。
(2)1molD与NaOH溶液反应,最多消耗__________NaOH
(3)卡托普利E的分子中有_____个手性碳原子,下列关于E说法不正确的是______。
a.卡托普利的水溶液呈酸性 b.在氧气中充分燃烧的产物中含有SO2
c.E的分子式为C9H16NO3S d.E存在属于芳香族化合物的同分异构体
(4)A与浓硫酸、甲醇反应生成M,M的同分异构体在核磁共振氢谱图中出现两种信号峰、且只有一种官能团,该同分异构体可能结构为_________、_________。M加聚反应生成高分子化合物N的方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从玉米穗轴、棉桃外皮中可提取出一种烃的含氧衍生物A,纯净的A为白色固体,易溶于水。为了研究A的组成和结构,进行了如下实验:
Ⅰ.将15gA在足量纯氧中充分燃烧,并使产物依次通过无水氯化钙、无水硫酸铜和碱石灰。实验后硫酸铜粉末没有变蓝,无水氯化钙增重9g,碱石灰增重22g。
Ⅱ.用一种现代分析技术测得其相对分子质量为150。
Ⅲ.取适量A配成水溶液,与银氨溶液共热,产生光亮如镜的银。
Ⅳ.控制一定条件,使A与足量乙酸发生酯化反应,测得产物的相对分子质量为318。
已知:A分子中无支链含![]() 结构的分子不稳定。
结构的分子不稳定。
请回答下列问题:
(1)A分子中C、H、O的原子个数比为___,A的分子式为___。
(2)步骤Ⅱ中采用的技术为(______)
A.元素分析 B.红外光谱 C.核磁共振谱 D.质谱法
(3)A中所含官能团的名称为___。
(4)步骤Ⅳ中发生反应的化学方程式为___。
(5)A加氢变成一种更有实用价值的化合物B,B可作为糖尿病人的甜味剂,其结构简式为___,根据系统命名法,B的名称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,回答下列问题:
I.一定温度下,在容积为2L的恒容密闭容器中进行反应:aM(g)bN(g),M、N的物质的量随时间的变化曲线如下图所示:
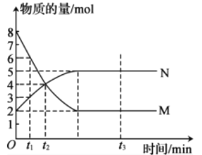
(1)此反应的化学方程式中,已知化学计量数之比为最简整数比,则b=________。
(2)若t2—t1=10min,则从t1到t2时刻,平均反应速率v(N)=________。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
II.一种新型催化剂用于 NO 和 CO 的反应:2NO+2CO2CO2 +N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验序号 | t(℃) | NO 初始浓度(mo1L-1) | CO初始浓度 (mo1L-1) | 催化剂的比表面积 (m2 g-1) |
I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
II | 280 | 1.20×10-3 | b | 124 |
III | 350 | a | 5.80×10-3 | 82 |
(1)表中,a=______,b=______。
(2)能验证温度对化学反应速率的影响规律的实验是________(填实验序号)。
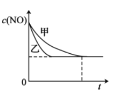
(3)实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的曲线是___________(填“甲”或“乙”)。
(4)若在容积固定的绝热容器中发生反应2NO+2CO2CO2 +N2,则不能说明该反应已达到平衡状态的是_________(填标号)。
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变 C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟镍是丁二酮肟在氨性溶液(pH=8~9)中与Ni2+发生反应生成的沉淀,该反应常用作实验室中检验镍离子。其结构如图所示,下列对该物质的分析与判断中,正确的是
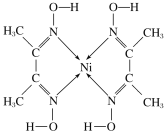
A.该物质中Ni原子具有空轨道,是配合物的配体
B.该物质中C、N、O原子存在孤电子对
C.该物质的分子中含有的化学键有共价键和配位键
D.该物质中碳原子的杂化类型均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)现有质量为m g的气体A,它由双原子分子构成,它的摩尔质量为M g/mol,若阿伏加德罗常数用NA表示,则:
①该气体所含原子总数为______个。
②该气体在标准状况下的体积为______L。
③标准状况下V L该气体溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为d g/mL,则该溶液物质的量浓度为______。
(2)完成下列的化学用语:
①Al2(SO4)3在水溶液中的电离方程式:______。
②N2O5是酸性氧化物,写出N2O5与NaOH溶液反应的化学方程式______。
③硫酸镁溶液和氢氧化钡溶液反应的离子方程式:______。
④碳酸氢钠溶液和氢氧化钠溶液反应的离子方程式:______。
⑤根据离子方程式H++OH-=H2O,写一个符合条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是

A. Y、R两种元素的气态氢化物稳定性:Y>R
B. 简单离子的半径:X<Z<M
C. 最高价氧化物对应水化物的酸性:R<N
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是_____(填“Cu”或“Fe”);若Zn、Ag和稀盐酸构成原电池,正极发生_____反应(填“氧化“或还原”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9g。则导线中通过的电子的物质的量是____mol。
(2)肼-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的能量转化率高。已知:电流效率可用单位质量的燃料提供的电子数表示。肼-空气碱性(KOH为电解质)燃料电池、氨气-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的电流效率之比为____。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com