
【题目】(1)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是_____(填“Cu”或“Fe”);若Zn、Ag和稀盐酸构成原电池,正极发生_____反应(填“氧化“或还原”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9g。则导线中通过的电子的物质的量是____mol。
(2)肼-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的能量转化率高。已知:电流效率可用单位质量的燃料提供的电子数表示。肼-空气碱性(KOH为电解质)燃料电池、氨气-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的电流效率之比为____。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
【答案】 Cu 还原 0.2 17:24 2 小于 ![]() 或
或![]()
【解析】(1)Fe、Cu和浓硝酸构成原电池,Fe与浓硝酸发生钝化,而Cu与浓硝酸发生自发的氧化还原反应,Cu失去电子作负极;若Zn、Ag和稀盐酸构成原电池,锌与盐酸发生自发的氧化还原反应,所以银作正极,锌作负极;质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,锌作负极失去电子,铜作正极,以此来解答;
(2)燃料电池中燃料在负极通入,发生失去电子的氧化反应,据此解答。
(3)利用物质的量之比等于化学计量数之比计算x的值;根据随着反应的进行反应物的浓度减少,反应速率减慢,据此判断;相同条件下,压强之比等于物质的量之比,据此计算平衡后混合气体总的物质的量,利用差量法计算参加反应的A的物质的量,再根据转化率定义计算。
(1)原电池是将化学能转变为电能的装置,Fe、Cu和浓硝酸构成原电池,常温下Fe与浓硝酸发生钝化,而Cu与浓硝酸发生自发的氧化还原反应,Cu失去电子作负极,被氧化,正极上正5价的氮得到电子被还原生成二氧化氮,发生还原反应;若Zn、Ag和稀盐酸构成原电池,锌与盐酸发生自发的氧化还原反应,所以银作正极,发生得到电子的还原反应;质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,锌作负极失去电子,铜作正极,铜离子得到电子,1molZn失2mol电子,1mol铜离子得2mol电子,设转移电子物质的量为xmol,则:x/2 mol×65g/mol+x/2 mol×64g/mol=12.9g,解得x=0.2;
(2)肼-空气碱性(KOH为电解质)燃料电池中燃料肼在负极通入,发生失去电子的氧化反应。氧化产物为大气主要成分,即为氮气,电极反应式为N2H4-4e-+4OH-=N2+4H2O,1mol肼即32g肼失去4mol电子;氨气-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)中负极是氨气失去电子,电极反应式为2NH3-6e-+6OH-=N2+6H2O,2mol氨气即34g氨气失去6mol电子,所以二者的电流效率之比为![]() ;
;
(3)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,参加反应的A的物质的量为3mol-1.8mol=1.2mol,浓度是0.6mol/L,根据浓度变化量之比是化学计量数之比可知x=![]() ;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,故平衡后混合气体总的物质的量为(3mol+1mol)×p/p0=4p/p0mol,故平衡后混合气体物质的量减少量为(4-4p/p0)mol,则根据方程式可知
;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,故平衡后混合气体总的物质的量为(3mol+1mol)×p/p0=4p/p0mol,故平衡后混合气体物质的量减少量为(4-4p/p0)mol,则根据方程式可知
3A(g)+B(g)![]() 2C(g) 物质的量减少△n
2C(g) 物质的量减少△n
3 2
n(A) (4-4p/p0)mol
故n(A)=(6-6p/p0)mol
因此A的转化率=(6-6p/p0)mol/3mol×100%=![]() 。
。


科目:高中化学 来源: 题型:
【题目】根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55molL﹣1 , 盐酸的浓度为0.5molL﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(1)已知盐酸、NaOH溶液密度近似为1.00gcm﹣3 , 中和后混合液的比热容c=4.18×10﹣3kJg﹣1℃﹣1 , 则该反应的中和热为△H= .
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是 .
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,发生反应:A(g)+B(g)C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表,下列说法正确的是( )
t/s | 0 | 5 | 10 | 20 | 30 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.03 molL﹣1s﹣1
B.达到平衡时,B的转化率为80%
C.相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 molL﹣1
D.相同温度下,起始时向容器中充入0.20 mol A ,0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲测定市场上某H2O2消毒液质量分数,现进行如下操作
己知:2MnO4﹣+5H2O2+6H+═2Mn2++8H2O+5O2
操作①:取10.00mLH2O2溶液(密度为1.00gmL﹣1)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.200 0molL﹣1KMnO4溶液滴定;
操作③:用同样方法滴定,4次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00mL.请回答下列问题:
(1)滴定时盛装KMnO4溶液应选取的仪器是(填序号).
A.50mL酸式滴定管
B.50mL碱式滴定管
C.25mL酸式滴定管
D.25mL碱式滴定管
(2)是否需要选用指示剂(填“是”或“否”)达到滴定终点的现象是 .
(3)分析数据,计算该H2O2溶液中溶质的质量分数为(保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
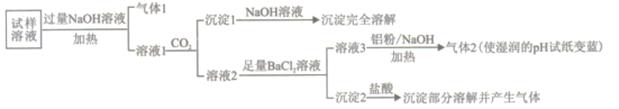
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表 格中“乙”应填写 .
(2)【测定 H2C2O4xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000molL﹣1 的 KMnO 标准溶液进行滴定;
请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是(选填 a、b).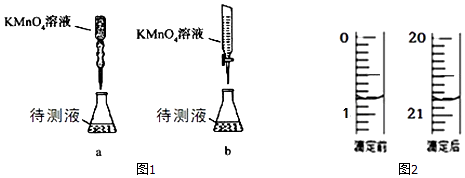
(4)由图2可知消耗 KMnO4溶液体积为mL;
(5)滴定过程中眼睛应注视;
(6)通过上述数据,求得 x= . 以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。不正确的操作顺序是
A.⑤②④①③B.⑤④②①③C.②⑤④①③D.①④②⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com