
【题目】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

回答下列问题:
(1)操作①的名称为__________,沉淀C的化学式为______________。
(2)在滤渣B中滴加稀硫酸时,发现反应速率比同浓度硫酸与纯铁粉反应要快,原因是_______________________。
(3)在滤渣B中滴加的硫酸可用SO2制取,可按以下三步进行:
已知25℃、101kPa时:
2SO2(g)+O2(g)2SO3(g) △H1=-197kJ/mol
H2O(g)=H2O(l) △H2=-44kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=-545kJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是_________________。
(4)设计实验方案,检测滤液D中含有的金属离子(试剂自选)________________________。
(5)常温下,乙同学将绿矾配成约0.1molL-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释其原因_______,该溶液中c(SO42-)-c(Fe2+)=______molL-1(填近似数值)。
(6)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,则反应④的总反应化学方程式为______________。
【答案】 过滤 Al(OH)3 形成铁铜原电池,加快了反应速率 SO3(g) + H2O(l) = H2SO4(l) △H =-130kJ/mol 取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色最后变成红褐色,证明D中有Fe2+或取少量滤液D加入硫氰化钾溶液,无现象,再加入氯水,显血红色,则证明D中有Fe2+。(其它合理答案也得分) Fe2+ + 2H2O Fe(OH)2+ 2H+ 5×10-4 Cu + H2O2+ H2SO4+ 3H2O == CuSO4·5H2O或Cu+H2O2+ H2SO4== CuSO4+ 2H2O
【解析】合金加入足量的烧碱溶液后,金属铝溶解,过滤得滤渣为铁、铜;滤液A中含偏铝酸钠,通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,得到滤液D为硫酸亚铁溶液,蒸发浓缩、降温结晶得到绿矾,滤渣E主要为铜,铜中加和稀硫酸再加氧化剂Y如双氧水等,得硫酸铜溶液,蒸发浓缩、降温结晶得到胆矾;
(1)依据题给信息得出操作①后得到的是滤液和滤渣,故此分离操作为过滤;沉淀C的化学式为 Al(OH)3 ;
(2)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了许多微小的原电池,构成了电化学腐蚀,加快了反应速率;
(3)2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol①
H2O(g)H2O(l)△H2=-44kJ/mol②
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol③
依据盖斯定律③-①-2×②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260KJ/mol;即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
(4)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色;
(5)FeSO4溶液中,亚铁离子水解使溶液呈酸性,反应的离子方程式为Fe2++2H2OFe(OH)2+2H+,根据电荷守恒有2c(SO42-)-2c(Fe2+)=c(H+)-c(OH-)=1×10-3,所以(SO42-)-c(Fe2+)=5×10-4;
(6)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4+3H2O=CuSO45H2O。


科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为5 L,Z的平衡浓度变为原来的2倍
C. Y浓度变化表示的反应速率为0.0005 mol/(L·s )
D. 若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是

A. 图I所示的装置能将化学能转变为电能
B. 图II所示的反应为吸热反应
C. 中和反应中, 反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列转化关系中,烃A为石油的裂解气里含是较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:

(1)写出A 的结构简式____________。
(2)①的反应类型为___________。
(3)D物质中含氧原子团的名称为___________;写出HOCH2CH2OH与金属钠反应的化学方程式___________。
(4)写出反应②的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25molL﹣1min﹣1,下列说法正确的是( )
A. 该反应方程式中,x=1
B. 2min时,A的转化率为50%
C. 2min时,A的物质的量为0.75mol
D. 反应速率v(B)=0.25 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子。
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为_____,F的价层电子排布式为_________________。
(2)B、C、D的电负性由大到小的顺序为_________(用元素符号填写),C与A形成的分子CA3的VSEPR模型为__________。
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是______________________________。
(4)以E、F的单质为电极,组成如图所示的装置,E极的电极反应式为_____________________________。

(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀溶解的离子方程式为___________________________。
(6)F的晶胞结构(面心立方)如右图所示:已知两个最近的F的距离为acm,F的密度为__________g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)
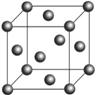
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )

A. C(s、石墨)=C(s、金刚石)ΔH=+1.9 kJ·mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的能量比1 mol金刚石的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。

其实验顺序是:
①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:
(1)实验中观察到的现象是_____________________。
(2)该实验中必须进行的一步实验操作是______________。
(3)该实验的原理是_______________________________。
(4)实验中反应的化学反应方程式是_______________________。
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系_________________。
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com