
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。

【答案】 E S 2s22s22p43s23p4或{ [Ne] 3s23p4} 正四面体 sp3 N 球形 Ca原子半径较大且价电子数较少,金属键较弱 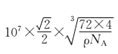 6
6
【解析】(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为700nm,故选E;
(2) 同周期从左至右,第一电离能逐渐增大;同族元素:从上至下第一电离能逐渐减小。元素S和Ca中,第一电离能较大的是S,S原子的基态原子核外电子排布式为2s22s22p43s23p4,故答案为:S;2s22s22p43s23p4;
(3) SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(4) 基态Ca原子中,核外电子占据最高能层是第4层,能层符号是N,占据该能层的电子为4s电子,电子云轮廓图形状为球形。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,Ca原子半径较大且价电子数较少,金属键较弱,导致金属钙的熔点、沸点等都比金属锰低,故答案为:N;球形;Ca原子半径较大且价电子数较少,金属键较弱;
(5)根据过氧化钙晶体的晶胞结构,晶胞中含有Ca2+的数目为8×![]() +6×
+6×![]() =4,含有O22-的数目为12×
=4,含有O22-的数目为12×![]() +1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=
+1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=![]() ,解得x=
,解得x=![]() cm=
cm=![]() ×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=
×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=![]() ×
×![]() ×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:
×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:![]() ×
×![]() ×107 ;6。
×107 ;6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合理使用食品添加剂不仅不会影响人体健康,还能有效改善食物品质和色、香、味,但有些物质严禁用于食品添加剂。下列说法正确的是
A.瘦肉精的使用对人体健康无害B.三聚氰胺作为牛奶的营养强化剂
C.苏丹红可用于食品的着色剂D.碳酸氢钠作为饼干的膨松剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 == 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠为原料,制取O2,设计出如下实验装置:

(1)A中制取CO2 的装置,应从下列图①、② 中选哪个图:________。

A装置中发生反应的离子方程式为 ______________________________。
(2)B装置的作用是________________,C装置内可能出现的现象是__________ 。为了检验E中收集到的气体,在取出集气瓶后,__________________________(简要表述操作过程及结论)。
(3)若E中的石灰水出现轻微白色浑浊,请说明原因:_______________ (用离子方程式及简要文字描述)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径不正确( )
A. 经常晒太阳 B. 经常饮用钙离子含量高的硬水
C. 经常饮用牛奶、豆奶 D. 适量补充维生素D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列常见物质按酸碱性的一定顺序依次排列正确的是
A. 厕所清洁剂、醋、肥皂、厨房清洁剂 B. 厕所清洁剂、厨房清洁剂、醋、肥皂
C. 醋、厕所清洁剂、肥皂、厨房清洁剂 D. 厨房清洁剂、醋、肥皂、厕所清洁剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A. ①>②>③>④ B. ①>②>④>③
C. ①=②>③=④ D. ①=②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣中的若干种离子,离子浓度均为0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl﹣
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com