
【题目】下列说法正确的是( )
A. 元素周期表有18个纵行
B. 形成化合物种类最多的元素位于元素周期表第二周期第ⅥA族
C. 原子序数等于该元素一个原子的质子数
D. 元素原子的核外电子层数等于该元素在元素周期表中的周期数
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是 NO、NO2 和 CO。处理汽车尾气,可实现绿色环保、节能减排。
(1)用 NaOH 溶液吸收 NO、NO2,当 n(NO)∶n(NO2)=1 时只生成一种盐,该盐的化学式为 _________ 。
(2)已知:①CO 的燃烧热△H1=-282 kJ·mol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183 kJ·mol1。
写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式______________________。
(3)在密闭容器中充入 10molCO 和 8molNO,发生反应,如图为平衡时 NO 的体积分数与温度,压强的关系。
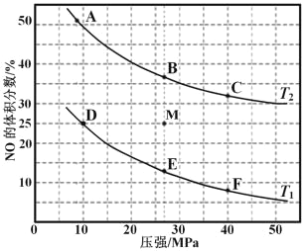
①若反应在恒容密闭容器中进行,下列图像正确且能说明反应达到平衡状态的是_____。
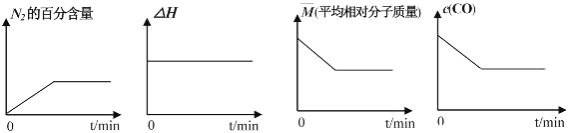
A B C D
②该反应达到平衡后,为在提高反应速率的同时提高 NO 的转化率,可采取的措施有_____(填字母)。
A.升高温度 B.缩小容器的体积
C.增加 CO 的浓度 D.改用高效催化剂
③在压强为 10MPa、温度为 T1 条件下,若反应进行到 20 min 达到平衡状态,容器的体积为 4 L,则此时 NO 的转化率=________________ ,用 N2 的浓度变化表示的平均反应速率 v(N2)= _______________,该温度下平衡常数 Kp=___________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
④若在 M 点对反应容器降温,同时缩小体积至体系压强增大,重新达到的化学平衡状态可能是图中 A~F 点中的_____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,钢铁与食盐水接触,发生吸氧腐蚀,在负极上发生的电极反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2↑
C. Na++e-=NaD. 2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器甲、乙中,依次充入氧原子数目相同的O2、O3两种气体,若它们的温度和密度均相同。下列说法正确的是
A. 气体体积:甲>乙 B. 气体的质量:甲<乙
C. 气体的分子数:甲<乙 D. 气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较过氧化氢在四种不同条件下发生分解反应:2H2O2=2H2O+O2↑,其中产生O2的反应速率最大的试验编号是( )
实验编号 | 温度 | 过氧化氢的质量分数 | 催化剂 |
A | 20℃ | 4% | 无 |
B | 50℃ | 4% | 有 |
C | 20℃ | 12% | 无 |
D | 50℃ | 12% | 有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
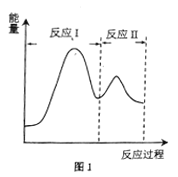
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com