
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
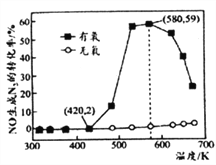
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
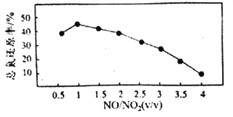
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
【答案】 ![]() -2317.0kJ·mol-1
-2317.0kJ·mol-1 ![]() 提高 BC 催化剂活性降低(或温度升高,NH3与NO反应的平衡向逆反应方向移动、温度升高发生了副反应4NH3+7O2=4NO2+6H2O) NO与O2反应生成NO2,NO2更容易与NH3反应 (NH2)2CO+NO+NO2=2N2+CO2+2H2O NO不溶于水,难以与尿素接触反应
提高 BC 催化剂活性降低(或温度升高,NH3与NO反应的平衡向逆反应方向移动、温度升高发生了副反应4NH3+7O2=4NO2+6H2O) NO与O2反应生成NO2,NO2更容易与NH3反应 (NH2)2CO+NO+NO2=2N2+CO2+2H2O NO不溶于水,难以与尿素接触反应
【解析】Ⅰ.(1)氮原子和氢原子间形成单键,NH3的电子式![]() ;正确答案:
;正确答案:![]() 。
。
(2)根据盖斯定律可知:③-②×5-6×①,整理后可得4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)△H=-2317.0kJ·mol-1,平衡常数为生成物浓度的幂之积除以反应物浓度幂之积,所以该反应的平衡常数K的表达式为![]() ;该反应正反应为一个气体体积缩小的反应,增加压强,平衡右移,反应中NO的转化率将提高;正确答案:
;该反应正反应为一个气体体积缩小的反应,增加压强,平衡右移,反应中NO的转化率将提高;正确答案: ![]() ; 提高。
; 提高。
(3)针对反应4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)△H=-2317.0kJ·mol-1来说,如果c(NH3)=c(N2),不能 说明各组分浓度保持不变,无法判断该反应达到平衡状态,A错误;该反应正反应为一个气体体积缩小的反应,当容器中压强不变时,该反应达到平衡状态,B正确;该反应向右进行,气体总质量减小,但是容器的体积不变,所以容器中混合气体的密度不变时,可以判定该反应达到平衡状态;C正确;根据反应可知:12molN-H键断裂,反应向右进行,同时生成12molO-H键,反应向右进行,速率方向同向,不能判断该反应达到平衡状态,D错误;正确选项BC。
(4)根据图像可知:在有氧条件下,温度580K之后NO生成N2的转化率降低,由于该反应为放热反应,所以温度升高,NH3与NO反应的平衡向逆反应方向移动,导致NO转化率降低,也可能为温度升高发生了副反应4NH3+7O2=4NO2+6H2O或催化剂活性降低,都有可能导致NO转化率降低;在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是NO与O2反应生成NO2,NO2更容易与NH3反应;正确答案:催化剂活性降低(或温度升高,NH3与NO反应的平衡向逆反应方向移动、温度升高发生了副反应4NH3+7O2=4NO2+6H2O) ;NO与O2反应生成NO2,NO2更容易与NH3反应。
(5)尿素[(NH2)2CO]中氮元素化合价为-3价,而NO和NO2混合气中的氮元素的化合价分别为+2价、+4价,三种物质混合后氮元素发生了归中反应,生成氮气和二氧化碳;反应的化学方程式为(NH2)2CO+NO+NO2=2N2+CO2+2H2O;正确答案:(NH2)2CO+NO+NO2=2N2+CO2+2H2O。
(6)随着NO和NO2配比的提高,NO的量增多,而NO不溶于水,也不与水反应,难以与尿素接触反应,造成总氮还原率降低;正确答案:NO不溶于水,难以与尿素接触反应。


科目:高中化学 来源: 题型:
【题目】区别棉花和羊毛的最简单的方法是( )
A.加入稀硫酸后加热使之水解,检验水解产物能否发生银镜反应
B.浸入浓硝酸中,观察其颜色是否变黄色
C.在火中灼烧,闻其是否有烧焦羽毛的气味
D.通过化学方法测其组成中是否含有硫、氮等元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应:3A(g)+B(g) ![]() xC(g)。
xC(g)。
Ⅰ.将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( )
A. 若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大
B. 若向Ⅰ平衡体系中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C. 若x=2,则Ⅱ体系起始物质的量应满足3n(B) > n(A)+3
D. 若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.米饭在咀嚼时产生甜味的原因是淀粉的水解
C.油脂是人体必需的营养物质之一
D.工业上常利用蛋白质的水解反应来制取肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com