
【题目】X、Y﹣、Z+三种微粒的电子层结构相同,则一定不能再相等的是( )
A.中子数
B.质量数
C.电子数
D.核电荷数
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )
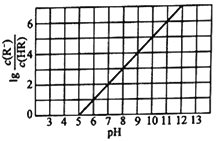
A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
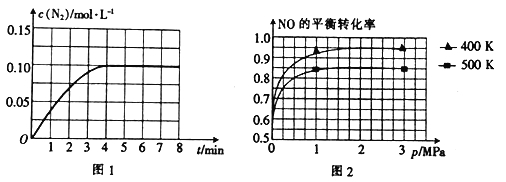
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ molL-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10mL10%的NaOH溶液,再加入约2 mL1%的硫酸铜溶液,得到强碱性的混合液。下列各对物质不能用这碱性混合物鉴别的是( )
A. 葡萄糖与蔗糖 B. 蛋白质与淀粉
C. 硬脂酸与油酸 D. 甲酸钠与乙酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性;
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为16.0g;
③加热,开始反应,直到不再有气体产生为止;
④测量排入量筒中水的体积为284.3mL,换算成标准状况下氧气的体积为279.0mL;
⑤准确称量试管和残留物的质量为15.6g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?______.
(2)以下是测量收集到气体体积必须包括的几个步骤: ①调整量筒的高度使广口瓶和量筒内的液面高度相同;②使试管和广口瓶内气体都冷却至室温;③读取量筒内液体的体积,这三步操作的正确顺序是___________________________(请填写步骤代号),进行③的实验操作时,若仰视读数,则读取氧气的体积_______________(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是___________________mol;实验测得氧气的气体摩尔体积是____________L/mol(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
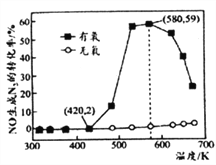
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
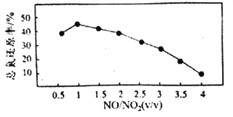
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(?)+aB(g) ![]() C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com