
【题目】在恒温恒容的密闭容器中,发生反应:3A(g)+B(g) ![]() xC(g)。
xC(g)。
Ⅰ.将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( )
A. 若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大
B. 若向Ⅰ平衡体系中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C. 若x=2,则Ⅱ体系起始物质的量应满足3n(B) > n(A)+3
D. 若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4
【答案】D
【解析】A.由于x值不确定,则若Ⅰ达平衡时,A、B、C各增加1mol,B的转化率不能确定,故A错误;B.因容器体积不变,若x=4时,C的体积分数应为a,现大于a,x应小于4,促进平衡正向移动,故B错误;C.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,则n(A)+ ![]() n(C)=3,n(B)+
n(C)=3,n(B)+ ![]() n(C)=2,若x=2,二者联式可得3n(B)=n(A)+3,故C错误;D.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+
n(C)=2,若x=2,二者联式可得3n(B)=n(A)+3,故C错误;D.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+ ![]() n(C)=3,n(B)+
n(C)=3,n(B)+ ![]() n(C)=2,若x=4,二者联式可得3n(C)+8n(A)═12n(B),故D正确;故选D。
n(C)=2,若x=4,二者联式可得3n(C)+8n(A)═12n(B),故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性;
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为16.0g;
③加热,开始反应,直到不再有气体产生为止;
④测量排入量筒中水的体积为284.3mL,换算成标准状况下氧气的体积为279.0mL;
⑤准确称量试管和残留物的质量为15.6g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?______.
(2)以下是测量收集到气体体积必须包括的几个步骤: ①调整量筒的高度使广口瓶和量筒内的液面高度相同;②使试管和广口瓶内气体都冷却至室温;③读取量筒内液体的体积,这三步操作的正确顺序是___________________________(请填写步骤代号),进行③的实验操作时,若仰视读数,则读取氧气的体积_______________(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是___________________mol;实验测得氧气的气体摩尔体积是____________L/mol(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
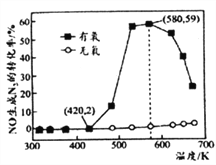
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
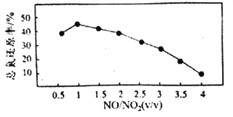
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 高温加热氧化镁和碳的混合物可以制单质镁
B. 铁的冶炼过程是通过置换反应得到单质铁
C. 海水提溴的过程中不发生氧化还原反应
D. 乙烯、丙烯、甲烷等主要化工基本原料都可以由石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中
B.乙烯通入溴水中
C.苯与液溴在FeBr3催化下反应
D.甲烷与氯气在一定条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以有机物A 合成聚酯类高分子化合物F 的路线如下:

已知: 
(1) A生成B 的反应类型为_________,C 中官能团的名称为__________ 。
(2) D 与NaOH 水溶液反应的化学方程式为__________ 。
(3) ①E 生成F 的化学方程式为__________。
②若F的平均相对分子质量为20000,则其平均聚合度为________ (填选项字母)。
A.54 B.108 C.119 D.133
(4) E 在一定条件下还可以合成含有六元环结构的G,G 的结构简式为__________。
(5) 满足下列条件的C 的同分异构体有___种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4 个碳原子上各连有一个取代基
②1mol 该物质与新制氢氧化铜悬浊液反应产生2mol 砖红色沉淀
(6) 写出以![]() 为原料(其他试剂任选) 制备化合物
为原料(其他试剂任选) 制备化合物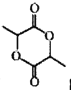 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:  。___________________。
。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(?)+aB(g) ![]() C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某水溶液常温下pH从0到14的范围内H2CO3、HCO3-、CO32-三种成分平衡时组成分数,下列叙述正确的是
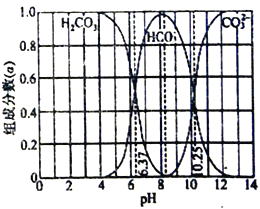
A. 此图是1.0mol/L碳酸钠溶液滴定1.0mol/L盐酸的滴定曲线
B. 向pH=10.25的溶液中通HCl气体使pH=7,此时c(H2CO3)>c(Cl-)=c(HCO3-)>c(CO32-)
C. 人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D. 该温度下,碳酸氢根的水解平衡常数Kh=10-3.75
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com