
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
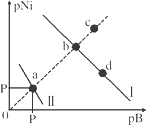
A. 对于曲线I,在b点加热,b点向c点移动
B. 常温下NiCO3的溶解度大于NiS的溶解度
C. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
D. P为3.5且对应的阴离子是CO32-
【答案】A
【解析】
A.一般而言,加热可使难溶电解质的溶解度增大,其溶度积常数增大,所以溶液中c(Ni2+)和c(B2-)都增大,但pNi和pB存在关系为:pNi=pKsp(NiB)-pB。所以对于曲线I,在b点加热,b点不是向c点移动,而是向a点方向移动,故A错误;
B.NiS和NiCO3是同类型难溶电解质,由于Ksp(NiCO3)=1.0×10-7>Ksp(NiS)=1.0×10-21,所以常温下NiCO3的溶解度大于NiS的溶解度,故B正确;
C.对于d所处溶液,有Ksp(NiB)=c(Ni2+)c(B2-),向d点对应的溶液中加入对应阴离子的钠盐,沉淀溶解平衡逆向移动,即c(B2-)增大,则c(Ni2+)减小,pNi增大,即d点向b点移动,故C正确;
D.产生NiS或者NiCO3,则有pNi+pB=pKsp(NiB),由于Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7,所以P点对应的是较小的pKsp(NiB),即Ksp(NiB)较大,因此P点对应的是NiCO3,pNi=pB=![]() =3.5,故D正确;
=3.5,故D正确;
答案选A。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】已知400℃和1.01×105Pa时的气体摩尔体积为55.20 L/mol,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)=mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为 ( )
A.58.80B.6.00C.39.74D.16.13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
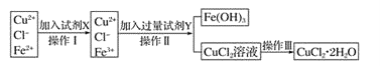
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
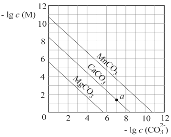
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D. a点表示的溶液中,c(Ca2+)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A.2H2O2 ![]() 2H2O + O2↑B.NH4Cl
2H2O + O2↑B.NH4Cl![]() NH3↑ + HCl↑
NH3↑ + HCl↑
C.2Al + Fe2O3![]() 2Fe + Al2O3D.Cu + 2H2SO4(浓)
2Fe + Al2O3D.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清。
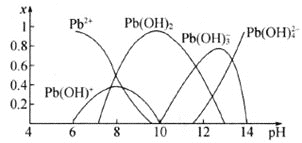
(1)若采用氢氧化物沉淀法除去溶液中的Pb2+,应将溶液的pH调至约为___。pH≥13时,溶液中发生的主要反应的离子方程式为___。
(2)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致___。已知Kap(PbS)=8.0×10-28,国家规定的废水排放标准中铅含量不高于0.5 mgL-1,若某工厂处理过的废水中S2-浓度为2.0×10-20molL-1,该废水中铅含量___(填“已经”或“尚未”)达到国家规定的排放标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com