
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| (1+x)3 |
| (1-x)3 |
| 1.7 |
| 2.0 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
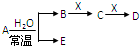 已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)
已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)| A、若E为氧化物,则X一定为Fe |
| B、若E为氧化物,则在A与水的反应中,氧化剂和还原剂的质量比为1:2 |
| C、若E为单质气体,D为白色沉淀,B可能是共价化合物,也可能是离子化合物 |
| D、若B为单质气体,X可能为C、Na、N2+等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
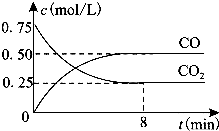 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mo lCO2 | 4mol FeO、3mol CO |
| CO的浓度(mol?L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | P1 | P2 |
| 气态反应物的转化率 | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com