
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是
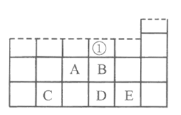
A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
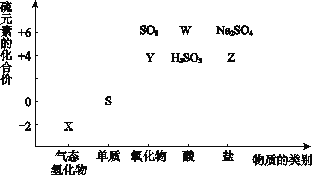
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
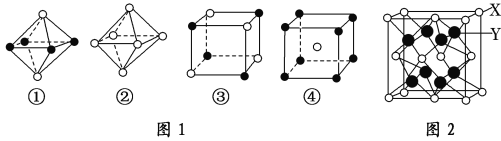
(1)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为___________。P形成的三种酸的酸性由强到弱的顺序为:HPO3>H3PO4>H3PO3,原因是___________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子价电子排布式为___________________,Q2+的未成对电子数是______________。
(3)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图是图1中的______________。
(4)[Cu(NH3)4]2+配离子中存在的化学键类型有_____________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______________(填序号)
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如图2所示,其中X和Y的相对原子质量分别为a和b,NA表示阿伏加德罗常数,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是_____________pm(用含ρ、a、b、NA的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
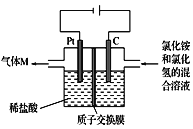
A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜从右侧向左侧迁移
B.石墨极的电极反应式为NH4++3Cl--6e-==NCl3+4H+
C.可用湿润的淀粉-KI试纸检验气体M
D.电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验事实得出的结论正确的是
实验事实 | 结论 | |
A | 某物质在熔融态下能导电 | 该物质一定是电解质 |
B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | SO2的水溶液能导电 | SO2为电解质 |
D | 已知:Cl2+2FeCl2=2FeCl3反应能发生 | 氧化性:Cl2>FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
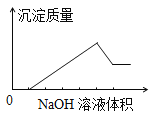
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产苯乙烯是利用乙苯的脱氢反应如下,针对上述反应,在其它条件不变时,下列说法正确的是( )

A. 加入适当催化剂,可以提高苯乙烯的产量
B. 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C. 仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D. 加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com