
【题目】锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与 Ca 和Ba同属于同族。
(1)Sr 的原子序数是 ,碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
I.将天青石矿粉和Na2CO3溶液充分混合,过滤;
II.将滤渣溶于盐酸,过滤;
III.向Ⅱ所得滤液中加入浓硫酸,过滤;
IV.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
V.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:i.相同温度时的Ksp :BaSO4<SrCO3<SrSO4<CaSO4
ii.生成氢氧化物沉淀的pH

已知氢氧化亚铁的溶度积为1×10—15则Fe2+完全沉淀的pH值为 (完全沉淀时Fe2+的浓度小于1×10—5)
①I中,反应的化学方程式是 。
②II中,能与盐酸反应溶解的物质有 。
③加入次氯酸的有关离子方程式为 ;IV加入氨水的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的Na+ 、Cl- 、SO42-
b.V中反应时,升高温度一定可以提高SrCO3的生成速率
c.V中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率
【答案】(1)38;<;同一主族元素,原子最外层电子数相同,电子层数越多,原子半径越大,金属性越强,则最高价氧化物对应的水化物的酸性越强;
(2)①SrSO4+Na2CO3=SrCO3+Na2SO4;②SrCO3、BaCO3、FeO、Fe2O3、Al2O3;③将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全;④ac。
【解析】
试题分析:1)金属性Sr<Ba,则碱性:Sr(OH)2<Ba(OH)2,锶的化学性质与钙和钡类似,是因同一主族元素,原子最外层电子数相同,电子层数越多,原子半径越大,金属性越强,则最高价氧化物对应的水化物的酸性越强;
(2)用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.相同温度时溶解度SrCO3<SrSO4,溶解度大的物质能转化为溶解度小的物质,所以将天青石矿粉和Na2CO3溶液充分混合,发生的反应为SrSO4+Na2CO3=SrCO3+Na2SO4,然后过滤;
Ⅱ.滤渣含有SrCO3、BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2,将滤渣溶于盐酸,能和稀盐酸反应的物质有碳酸盐、金属氧化物,然后过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,能和浓硫酸反应的为钡离子,生成硫酸钡沉淀,然后过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,次氯酸具有强氧化性,能将亚铁离子氧化生成铁离子,充分反应后再用氨水调pH约为7,根据生成氢氧化物沉淀pH知,得到的沉淀是Fe(OH)3、Al(OH)3,然后过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,发生复分解反应生成沉淀SrCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3,
①I中只有SrSO4与碳酸钠溶液反应,反应为SrSO4+Na2CO3=SrCO3+Na2SO4;
②由物质的溶解性可知,只有碳酸盐和金属氧化物与盐酸反应,则SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应,
③由生成氢氧化物沉淀的pH可知,Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全;
④a、分析过程可知该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-,故a正确;
b、Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,发生反应SrSO4+Na2CO3=SrCO3+Na2SO4过滤不能除去二氧化硅,Ⅱ.向滤渣中加入足量盐酸充分反应,过滤,二氧化硅不溶于盐酸,过滤除去,故b错误;
c、在这时候氢氧化锶与碳酸氢铵反应时会有一个副反应生成的一水合氨与碳酸氢铵的反应,浪费了一部分碳酸氢铵,如果加入溶液不会影响反应过程但是会稀释一水合氨的浓度,使得副反应更慢、占的比例从而更少,也就是提高了碳酸氢铵的利用率,故c正确;
故选ac。


科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.氢氧化钙的摩尔质量是74 g·mol1 B.阿伏加德罗常数是6.02×1023
C.1 mol H D.1 mol CO约含有6.02×1023个CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.CuO、Na2O和Na2O2都是碱性氧化物
B.SO2能与碱反应生成盐和水,因此SO2属于酸性氧化物
C.NH4Cl不含金属阳离子,不属于盐
D.金属氧化物都是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.不同的原子之间只能构成共价化合物
B.单质中不一定存在非极性键
C.非金属原子之间只能构成共价化合物
D.有离子的物质一定有阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计了如下装置进行实验。 烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
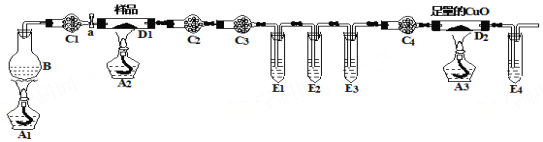
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为 (写化学式)。
(2)该装置中有3个酒精灯,整个实验过程至少应该点 次酒精灯,最后一次点燃的是 。(填酒精灯下的字母)
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E3的作用是: 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是 。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示): 。
(3)硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g硅烷自燃放出的热量为a kJ,其热化学方程式为 。
(4)已知在密闭容器中将2.0molCO与10mol H2O混合加热到800℃,达到下列平衡:
CO (g) + H2O (g) ![]() CO2 (g) + H2 (g) K=1.0则一氧化碳在此反应条件下的转化率是 。
CO2 (g) + H2 (g) K=1.0则一氧化碳在此反应条件下的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钠溶液与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O
C. 向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO![]() +2H2O
+2H2O
D. 稀硫酸和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com