
【题目】已知常温:Ksp(PbI2)=4×10-6,Ksp(PbS)=8×10-28。取适量黄色PbI2固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是

A. A点处可表示PbI2的不饱和溶液
B. T时刻有可能向该PbI2溶液中加人了KI固体
C. 常温下PbI2饱和溶液中的c(I-)=10-2mol/L
D. 向A点处的PbI2溶液中加入100mL 2×10-3mol/L的Na2S溶液,平衡后溶液中的c(Pb2+)<4×10-3mol/L
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法不正确的是( )
A.第15列某元素能与其他元素化合形成碱性气体
B.第2列元素中肯定没有非金属元素
C.第17列的第一种元素的原子序数为9
D.短周期中能与强碱反应产生H2的金属元素位于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池可将化学能转化为电能.设计两种类型的原电池,探究其能量转化效率.限选材料:ZnSO4(aq),CuSO4(aq);铜片,锌片和导线.
(1)①完成原电池甲的装置示意图(如图),并作相应标注.要求:在同一烧杯中,电极与溶液含相同的金属元素. 
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 .
③甲乙两种原电池中可更有效地将化学能转化为电能的是 , 其原因是 .
④盐桥中向CuSO4溶液中迁移的离子是(填序号)
A.K+ B.NO3﹣ C.Ag+ D.SO42﹣
(2)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图2中电解池相连,其中,a为电解液,X和Y是两块电极板,则: ①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 . 通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:
(1)识别下图中仪器。A的名称是_____,B是_____

(2)实验时,可向装置 C 中缓慢通入干燥的氮气,直至溴完全导入 三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有_____的性质;实验中不能用干燥空气代替干燥N2,原因是:____MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是____。过滤必须用到的玻璃仪器是:____。
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是____。过滤必须用到的玻璃仪器是:____。
(3)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:____。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是____。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是____(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用镁一次氯酸钠燃料电池作电源模拟消除工业酸性废水中的Cr2O72-的过程(将“Cr2O72-”还原为“Cr3+”),装置如图所示。下列说法中错误的是
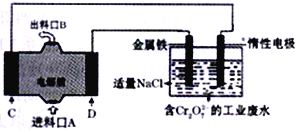
A. 金属铁电极的反应为:Fe-2e-=Fe2+
B. 装置中电子的流动路线是: C电极→惰性电极→金属铁电极→D电极
C. 装置工作过程中消耗14.4gMg,理论上可消除Cr2O72-0.1mol
D. 将Cr2O72-处理后的废水比原工业废水的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用钛矿石(主要成分为FeTiO3,主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离了方程式是:_____________、___________。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有_________________、__________________________(写出两种方法)。
②步骤II中加入Fe的目的是___________________;分离出FeSO4晶体的操作是___________。
③步骤III形成的TiO2·nH2O 为胶体,其反应的化学方程式为____________________。
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是____________,可能生成的气体是__________________。
方法二: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)![]() TiCl4(g)+O2(g) △H=+ 151kJ/mol
TiCl4(g)+O2(g) △H=+ 151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 0.60 | 0.30 |
t1 | 0.40 | |
t2 | 0.10 |
A.反应在t1min内的平均速率为v(H2)=0.20/t1molL﹣1min﹣1
B.保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
D.700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
回答下列问题:
(1)芳香烃R分子的官能团是_________(填官能团符号),R的最简单同系物是_____(填化学名称)。
(2)反应②的化学方程式为__________________。
(3)③和⑦的反应类型分别属于____________、______________________。
(4)高聚物J的结构简式为________________________。
(5)反应⑥的反应条件是______________________。
(6)H与T互为同分异构体,符合下列性质特征的H分子共有________种。
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
(7)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):____________________________________________________。
的合成路线(无机试剂任选):____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com