
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |


科目:高中化学 来源: 题型:
| A、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| B、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ |
| C、铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ |
| D、硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
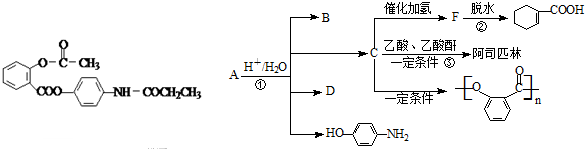
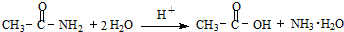
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.25 mol?L-1 |
| B、2.5 mol?L-1 |
| C、0.50 mol?L-1 |
| D、1.0 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含查看答案和解析>>
科目:高中化学 来源: 题型:
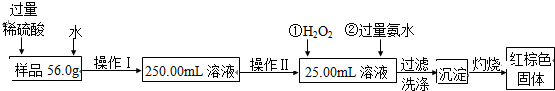
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(SO2)/(mol/L) | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
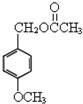 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: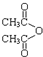 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com